Câu hỏi trang 92 Mở đầu
Trong y khoa, gây mê là phương pháp làm bệnh nhân mất ý thức, phục hồi được sau một thời gian, không đau và đảm bảo an toàn trong suốt quá trình phẫu thuật. Halothane được dùng làm thuốc gây mê, phù hợp cho nhiều độ tuổi, ít ảnh hưởng đến sức khoẻ của bệnh nhân trong và sau phẫu thuật. Công thức cấu tạo của phân tử halothane là:
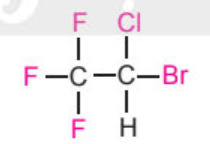
Halothane là dẫn xuất halogen của hydrocarbon, có tính chất đặc trưng và ứng dụng thực tiễn. Dẫn xuất halogen của hydrocarbon là gì? Có những tính chất và ứng dụng trong lĩnh vực nào?

Nêu khái niệm, tính chất, ứng dụng của dẫn xuất halogen của hydrocarbon.

- Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng một hay nhiều nguyên tử halogen, ta được dẫn xuất halogen của hydrocarbon.
- Tính chất:
+ Tính chất vật lý của dẫn xuất halogen: nhiệt độ sôi của các dẫn xuất halogen có xu hướng tăng dần theo chiều tăng khối lượng phân tử; dẫn xuất halogen không tan trong nước nhưng tan trong các dung môi hữu cơ như alcohol, ether, benzene.
+ Tính chất hoá học: phản ứng thế nguyên tử halogen bằng nhóm OH, phản ứng tách hydrogen halide.
- Dẫn xuất halogen được ứng dụng trong nhiều lĩnh vực như: làm dung môi hữu cơ, sản xuất các loại thuốc bảo vệ thực vật, thuốc tăng trưởng thực vật, chất dẻo, sử dụng trong công nghiệp nhiệt lạnh…
Câu hỏi trang 93 Câu hỏi 1
Em hãy cho biết thành phần các nguyên tố có trong dẫn xuất halogen của hydrocarbon.

Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng một hay nhiều nguyên tử halogen, ta được dẫn xuất halogen của hydrocarbon.

Thành phần các nguyên tố có trong dẫn xuất halogen của hydrocarbon gồm carbon, nguyên tố nhóm halogen (F, Cl, Br, I), có thể có hydrogen.
Câu hỏi trang 93 Luyện tập
Cho các chất sau: CH3Br, Cl2O7, F2C=CF2, CH2Cl2, HCl, COCl2 (phosgene). Chất nào là dẫn xuất halogen của hydrocarbon?

Thành phần các nguyên tố có trong dẫn xuất halogen của hydrocarbon gồm carbon, nguyên tố nhóm halogen (F, Cl, Br, I), có thể có hydrogen.

Dẫn xuất halogen của hydrocarbon: CH3Br, F2C=CF2, CH2Cl2.
Câu hỏi trang 93 Câu hỏi 2
Quan sát Ví dụ 1 và Ví dụ 2, cho biết cách đánh số thứ tự mạch carbon trong dẫn xuất halogen và dẫn xuất halogen có các loại đồng phân cấu tạo nào.

Đồng phân cấu tạo của dẫn xuất halogen gồm có đồng phân mạch carbon, đồng phân vị trí liên kết đối, liên kết ba và đồng phân vị trí nguyên tử halogen.

* Cách đánh số thứ tự mạch carbon trong dẫn xuất halogen:
- Với dẫn xuất halogen không có liên kết bội:

+ Mạch chính là mạch carbon dài nhất, chứa nguyên tử halogen.
+ Đánh số 1 từ phía carbon đầu mạch chính gần nguyên tử halogen hơn.
- Với dẫn xuất halogen có liên kết bội:
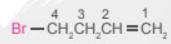
+ Mạch chính là mạch carbon dài nhất, chứa liên kết bội và nguyên tử halogen.
+ Đánh số 1 từ phía carbon đầu mạch chính gần liên kết bội hơn.
* Dẫn xuất halogen có các loại đồng phân cấu tạo:
- Đồng phân mạch carbon.
- Đồng phân vị trí liên kết đối, liên kết ba.
- Đồng phân vị trí nguyên tử halogen.
Câu hỏi trang 94 Luyện tập
Viết công thức cấu tạo và gọi tên thay thế của các đồng phân dẫn xuất halogen có công thức phân tử C3H7Cl.

- Công thức cấu tạo biểu diễn thứ tự và cách thức liên kết (liên kết đơn, liên kết bội) của các nguyên tử trong phân tử.
- Tên thay thế của dẫn xuất halogen:


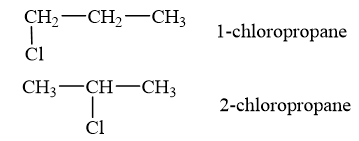
Câu hỏi trang 94 Câu hỏi 3
Dựa vào Bảng 15.2, cho biết xu hướng biến đổi nhiệt độ sôi của các dẫn xuất halogen theo chiều tăng độ dài mạch carbon (cùng loại halogen) và theo chiều tăng nguyên tử khối của halogen từ F, Cl, Br, I (cùng gốc alkyl).

Nhiệt độ sôi của các dẫn xuất halogen có xu hướng tăng dần theo chiều tăng khối lượng phân tử.

Nhiệt độ sôi của các dẫn xuất halogen tăng theo chiều tăng độ dài mạch carbon (cùng loại halogen).
Nhiệt độ sôi của các dẫn xuất halogen tăng theo chiều tăng nguyên tử khối của halogen từ F, Cl, Br, I (cùng gốc alkyl).
Câu hỏi trang 95 Luyện tập
Cho các chất ethanol (C2H5OH) và dichloromethane (CH2Cl2) vào 2 ống nghiệm chứa dung dịch CuSO4 loãng, lắc hỗn hợp và để yên như hình bên. Cho biết ống nghiệm nào chứa dichloromethane.


Dẫn xuất halogen không tan trong nước nhưng tan trong các dung môi hữu cơ như alcohol, ether, benzene.

Ống nghiệm (2) chứa dichloromethane vì dichloromethane không tan trong nước (có trong dung dịch CuSO4 loãng), làm dung dịch trong ống nghiệm bị tách lớp.
Câu hỏi trang 95 Câu hỏi 4
Trong thí nghiệm thuỷ phân bromoethane, giải thích tại sao cần phải rửa ion Br-.

Ion Br- kết hợp với Ag+ tạo kết tủa AgBr.

Rửa ion Br- nhằm đảm bảo trong dung dịch bromoethane không còn ion Br-. Để đảm bảo cho bước thí nghiệm sau, kết quả chính xác là ion Br- được sinh ra từ phản ứng thủy phân bromoethane.
Câu hỏi trang 95 Câu hỏi 5
Hãy cho biết mục đích của việc acid hoá dung dịch sau thuỷ phân bằng dung dịch HNO3. Có thể thay dung dịch HNO3 bằng dung dịch H2SO4 hoặc dung dịch HCl được không?

Acid hóa tạo môi trường acid. Ag2SO4 và AgCl là kết tủa.

- Acid hóa dung dịch sau khi thuỷ phân bằng dung dịch HNO3 để tránh trường hợp dư base, sinh ra kết tủa Ag2O:
Advertisements (Quảng cáo)
AgNO3 + NaOH → AgOH + NaNO3
2AgOH → Ag2O + H2O
- Không thể thay dung dịch HNO3 bằng dung dịch H2SO4 hay HCl vì AgNO3 có thể phản ứng với H2SO4 hay HCl tạo kết tủa Ag2SO4 hay AgCl làm sai kết quả thí nghiệm.
AgNO3 + HCl → AgCl↓ + HNO3
2AgNO3 + H2SO4 → Ag2SO4↓+ 2HNO3
Câu hỏi trang 95 Câu hỏi 6
Giải thích kết quả thí nghiệm ở Bước 4.

Dẫn xuất halogen mà nguyên tử halogen liên kết với nguyên tử carbon no có phản ứng thế nhóm –OH trong dung dịch kiềm, đun nóng.

Giải thích: + Phản ứng thủy phân bromoethane, tạo ra NaBr.
+ Sau đó nhỏ thêm dung dịch AgNO3, NaBr phản ứng với AgNO3 tạo kết tủa vàng nhạt AgBr.
NaBr + AgNO3 → AgBr↓ + NaNO3
Câu hỏi trang 96 Câu hỏi 7
Trong phản ứng tách hydrogen halide, cho biết nguyên tử hydrogen ở nguyên tử carbon nào được tách cùng với nguyên tử halogen ra khỏi dẫn xuất.

• Các dẫn xuất halogenoalkane có thể bị tách hydrogen halide để tạo thành alkene. Trường hợp có nhiều alkene được tạo thành thì sản phẩm chính được xác định theo quy tắc Zaitsev.
• Quy tắc Zaitsev: Trong phản ứng tách hydrogen halide (HX) ra khỏi dẫn xuất halogen, nguyên tử halogen (X) ưu tiên tách ra cùng với nguyên tử hydrogen (H) ở nguyên tử carbon bên cạnh có bậc cao hơn, tạo ra sản phẩm chính.

Trong phản ứng tách hydrogen halide, nguyên tử hydrogen ở nguyên tử carbon bên cạnh (carbon chứa halogen) được tách cùng với nguyên tử halogen ra khỏi dẫn xuất.
Nguyên tử halogen (X) ưu tiên tách ra cùng với nguyên tử hydrogen (H) ở nguyên tử carbon bên cạnh có bậc cao hơn, tạo ra sản phẩm chính (Quy tắc Zaitsev).
Câu hỏi trang 96 Luyện tập
Hoàn thành các phương trình hóa học:
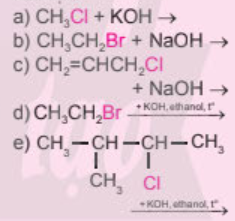

Phản ứng a, b, c thuộc phản ứng thế nguyên tử halogen bằng nhóm OH.
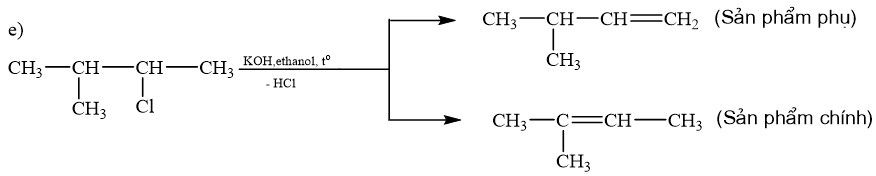
Phản ứng d, e thuộc phản ứng tách hydrogen halide.

\(\begin{array}{l}{\rm{a) C}}{{\rm{H}}_{\rm{3}}}{\rm{Cl + KOH}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{OH + KCl}}\\{\rm{b) C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{Br + NaOH}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{OH + NaBr}}\\{\rm{c) C}}{{\rm{H}}_{\rm{2}}}{\rm{ = CHC}}{{\rm{H}}_{\rm{2}}}{\rm{Cl + NaOH}} \to {\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{ = CHC}}{{\rm{H}}_{\rm{2}}}{\rm{OH + NaCl}}\end{array}\)
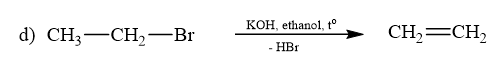
Câu hỏi trang 97 Câu hỏi 8
Hiện nay, vì yếu tố lợi nhuận mà vấn đề lạm dụng thuốc bảo vệ thựcvật, thuốc kích thích tăng trưởng gây tác hại nghiêm trọng đến sứckhoẻ người tiêu dùng. Hãy đưa ra hướng giải quyết về tình trạng trên.

Có thể đưa ra giải pháp dựa vào gợi ý dưới đây.

- Cần có chế tài xử phạt nghiêm khắc đối với các hành vi lạm dụng thuốc bảo vệ thực vật, thuốc kích thích tăng trưởng trong sản xuất nông nghiệp.
- Cần tìm kiếm và phát triển các sản phẩm thay thế an toàn, như các sản phẩm hữu cơ, các sản phẩm sinh học, các phương pháp canh tác xanh,...để giảm thiểu sự phụ thuộc vào thuốc bảo vệ thực vật và thuốc kích thích tăng trưởng.
- Tận dụng thiên địch.
Bài tập Bài 1
Gọi tên các dẫn xuất halogen
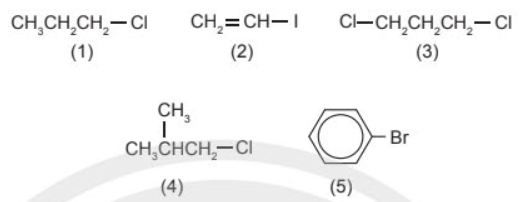

Tên thay thế của dẫn xuất halogen:


(1) 1 – chloropropane.
(2) iodoethene.
(3) 1,3 – dichloropropane.
(4) 1,2 - dichloropropane.
(5) bromobenzene.
Bài tập Bài 2
Cho sơ đồ biến đổi của 1-chloropropane như sau:
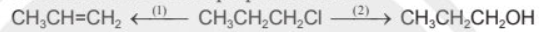
a) Gọi tên loại phản ứng (1), (2) và hoàn thành các phương trình hoá học.
b) Thực hiện 2 phản ứng theo sơ đồ trên khi thay hợp chất CH3CH2CH2Cl bằng 2-bromobutane. Xác định sản phẩm hữu cơ chính (nếu có) trong các phản ứng.

(1) Phản ứng tách hydrogen halide.
(2) Phản ứng thủy phân dẫn xuất halogen (phản ứng thế nguyên tử halogen bằng nhóm OH).

a) (1) Phản ứng tách hydrogen halide.
(2) Phản ứng thủy phân dẫn xuất halogen (phản ứng thế nguyên tử halogen bằng nhóm OH).
b)
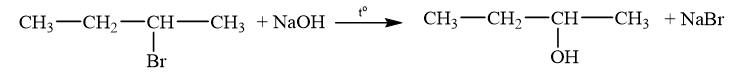
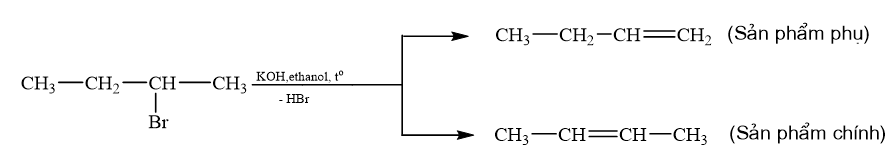
Bài tập Bài 3
CFC là hợp chất khó cháy, không độc và trơ về mặt hoá học. Trước đây CFC chủ yếu được sử dụng trong công nghiệp nhiệt lạnh. CFC không gây hại ở điều kiện thường, nhưng trên khí quyển của Trái Đất, chúng tồn tại trong khoảng 100 năm và khuếch tán lên tầng bình lưu. Dưới tác dụng của tia UV từ Mặt Trời, liên kết C-Cl của CFC bị phá vỡ, tạo ra gốc Cl tự do. Theo ước tính, mỗi gốc Cl tự do phá huỷ 1 triệu phân tử ozone. Việc không sử dụng CFC đã giúp lỗ hổng tầng ozone được thu hẹp. Ngày nay người ta đã sử dụng hợp chất nào để thay thế CFC trong công nghiệp làm lạnh để tránh việc phá huỷ tầng ozone?

Trước đây, các dẫn xuất chlorofluorocarbon (CFC) được dùng phổ biến trong công nghiệp nhiệt lạnh, nhưng gây tác hại nghiêm trọng đến tầng ozone, góp phần gây hiệu ứng nhà kính, biến đổi khí hậu. Hạn chế sản xuất, sử dụng và hướng tới xoá bỏ CFC là cần thiết. Các dẫn xuất hydrofluorocarbon (HFC) và hydrofluoroether (HFE) được dùng phổ biến trong công nghiệp nhiệt lạnh do không gây hại đến tầng ozone.

Ngày nay người ta đã sử dụng các dẫn xuất hydrofluorocarbon (HFC) và hydrofluoroether (HFE) trong công nghiệp nhiệt lạnh để tránh việc phá huỷ đến tầng ozone.
