Câu hỏi trang 35 Mở đầu
Sulfur (lưu huỳnh) còn được gọi là lưu hoàng, sinh diêm vàng, diêm sinh, đã được biết đến từ thời cổ đại. Nguyên tố sulfur có những tính chất gì và được ứng dụng vào sản xuất, đời sống của con người như thế nào?

Sulfur (S) nằm ở ô số 16, nhóm VIA trong bảng tuần hoàn.
Số oxi hóa của S: -2; 0; +2; +4; +6
Số oxi hóa của sulfur đơn chất là 0.

- Tính chất:
+ Tính chất vật lí: Chất rắn màu vàng, không tan trong nước, tan nhiều trong dung môi hữu cơ.
+ Tính chất hóa học: Sulfur vừa có tính oxi hóa, vừa có tính khử
- Ứng dụng: khoảng 90% lượng sulfur sản xuất được dùng để điều chế H2SO4 còn lại được dùng để lưu hoá cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,...
Câu hỏi trang 35 Câu hỏi
Quan sát Hình 6.1 và 6.2, hãy cho biết trong tự nhiên, sulfur tồn tại ở những dạng đơn chất nào?

Trong tự nhiên, sulfur tồn tại ở dạng đơn chất và hợp chất.

- Sulfur đơn chất lắng đọng thành những mỏ lớn, nằm giữa lớp đá sâu hàng trăm mét trong lòng đất.
- Sulfur ở dạng hợp chất trong nhiều quặng như quặng pyrite, quặng gypsum, quặng galena, quặng barite…
Câu hỏi trang 36 Câu hỏi 1
Quan sát Hình 6.3, hãy nêu một số tính chất vật lý của sulfur.

Quan sát Hình 6.3 và nêu được trạng thái vật lí, màu sắc của sulfur đơn chất.

Ở điều kiện thường, sulfur là chất rắn màu vàng.
Câu hỏi trang 36 Câu hỏi 2
Quan sát Hình 6.4, mô tả cấu tạo phân tử sulfur.

Quan sát Hình 6.4 và đếm số nguyên tử S trong phân tử sulfur.
Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.

Ở dạng phân tử, sulfur gồm 8 nguyên tử liên kết cộng hoá trị với nhau tạo thành mạch vòng.
Câu hỏi trang 36 Câu hỏi 3
Nêu hiện tượng xảy ra ở Thí nghiệm 1. Xác định vai trò của các chất trong phản ứng của Fe và S ở thí nghiệm này.

Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.

- Hiện tượng: Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, hỗn hợp cháy sáng đỏ và chuyển thành hợp chất màu đen (FeS).
- Phương trình:
Fe + S -> FeS
+ Fe có số oxi hóa tăng từ 0 lên +2, Fe là chất khử
+ S có số oxi hóa giảm từ 0 xuống -2, S là chất oxi hóa.
Câu hỏi trang 37 Câu hỏi 1
Nêu hiện tượng xảy ra ở Thí nghiệm 2. Xác định vai trò của các chất trong phản ứng của S và O2, ở thí nghiệm này.

Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.

- Hiện tượng: Khi đốt lưu huỳnh trong không khí, lưu huỳnh cháy cho ngọn lửa nhỏ màu xanh nhạt, sau đó cho lưu huỳnh cháy trong khí oxygen, cho ngọn lửa lớn hơn màu sáng xanh.
- Phương trình:
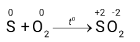
+ S có số oxi hóa tăng từ 0 lên +2, S là chất khử
+ O có số oxi hóa giảm từ 0 xuống -2, O2 là chất oxi hóa.
Câu hỏi trang 37 Câu hỏi 2
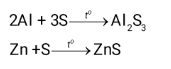
Viết phương trình hoá học của phản ứng xảy ra khi cho nhôm (aluminium) và kẽm (zinc) tác dụng với sulfur.

Sulfur oxi hóa được nhiều kim loại (trừ Pt, Ag, Au) ở nhiệt độ cao tạo muối sulfide.
Khi phản ứng với nhôm và kẽm, cho ra sản phẩm có số oxi hóa của sulfur là -2.

Câu hỏi trang 37 Câu hỏi 3
Thuỷ ngân rất độc. Hít phải hơi thuỷ ngân có thể gây hại cho hệ thần kinh, hệ tiêu hoá và hệ miễn dịch, gây nhiễm độc phổi và thận, nguy cơ dẫn đến tử vong. Hãy nêu cách xử lý thuỷ ngân khi nhiệt kế thuỷ ngân không may bị vỡ.

Sulfur oxi hóa được nhiều kim loại (trừ Pt, Ag, Au) ở nhiệt độ cao tạo muối sulfide.
Thủy ngân phản ứng với lưu huỳnh ở nhiệt độ thường.

- Thủy ngân rất dễ tan trong không khí do đó ta nên đóng cửa, tránh gió lùa và giảm nhiệt độ trong phòng.
- Khi xử lý, đeo găng tay do thuỷ ngân còn gây độc khi tiếp xúc trực tiếp với da.
- Để hạn chế hơi độc từ thủy ngân, có thể dùng bột lưu huỳnh rắc vào nơi rơi vãi thủy ngân, lưu huỳnh tác dụng với thủy ngân kim loại ở nhiệt độ thường tạo thành chất rắn HgS không bay hơi. Do đó ta có thể dùng chổi quét, thu gom HgS.
- Thủy ngân đã thu gom bắt buộc phải được đựng riêng, có dán nhãn lưu ý để được phân loại rác, không để chung vào rác thải sinh hoạt hay đổ xuống hệ thống nước thải công cộng gây ô nhiễm nguồn nước ngầm.
- Sau khi xử lý thủy ngân xong, mở cửa làm thông thoáng khu vực bị nhiễm độc, lau dọn khu vực này bằng xà phòng. Quần áo bị dính thủy ngân cần được ngâm, giặt trong nước lạnh khoảng 1 giờ, rồi ngâm tiếp bằng nước nóng 70-80 oC, xả bằng nước lạnh.
- Phương trình hóa học:
Hg + S →HgS
Câu hỏi trang 37 Câu hỏi 4
Hãy nêu một số ứng dụng của sulfur đơn chất trong đời sống và sản xuất.

Quan sát Hình 6.5. Một số ứng dụng của sulfur.

- Khoảng 90% lượng sulfur sản xuất được dùng để điều chế H2SO4
Advertisements (Quảng cáo)
- 10% còn lại được dùng để lưu hoá cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,...
Câu hỏi trang 38 Câu hỏi 1
Xác định tính oxi hóa, tính khử của mỗi chất trong các phản ứng hóa học (1) và (2).
\[\begin{array}{l}{\rm{S}}{{\rm{O}}_{\rm{2}}}{\rm{ + N}}{{\rm{O}}_{\rm{2}}} \to {\rm{S}}{{\rm{O}}_{\rm{3}}}{\rm{ + NO (1)}}\\{\rm{S}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{S}} \to 3{\rm{S + 2}}{{\rm{H}}_2}{\rm{O (2)}}\end{array}\]

Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.

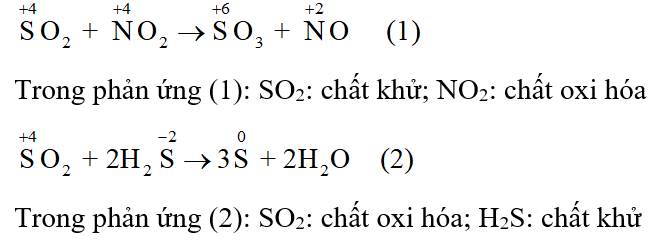
Câu hỏi trang 38 Câu hỏi 2
Nêu một số nguồn phát thải sulfur dioxide và tác hại của loại khí này.

Quan sát Hình 6.6: một số nguồn phát thải sulfur dioxide.
Sulfur dioxide là một oxide acid, tác dụng với nước sinh ra acid.

- Nguồn phát thải sulfur dioxide:
+ Trong tự nhiên: Núi lửa phun trào; các quá trình phân hủy, thối rữa xác động thực vật; các phản ứng hóa học giữa những khí tự nhiên hình thành sulfur dioxide;…
+ Tác động của con người: Các trung tâm nhiệt điện, các lò nung, lò hơi đốt nhiên liệu than, dầu và khí đốt có chứa lưu huỳnh hay các hợp chất có chứa lưu huỳnh; phương tiện giao thông, một số công đoạn trong công nghiệp hóa chất, luyện kim,… thải ra khí sulfur dioxide.
- Tác hại của sulfur dioxide:
+ Sức khỏe con người: SO2 kích ứng niêm mạc mắt và các đường hô hấp, gây viêm kết mạc, bỏng và đục giác mạc. Tiếp xúc với SO2 nồng độ cao có thể làm chết người do ngưng hô hấp. Ngoài ra, SO2 còn gây tác hại cho cơ quan tạo máu (tủy, lách), gây nhiễm độc da, gây rối loạn chuyển hóa protein – đường, gây thiếu các vitamin B và C, ức chế enzym oxidase.
+ Môi trường: Khí SO2 trong bầu khí quyển là một trong những nguyên nhân chính gây nên hiện tượng mưa acid.
Câu hỏi trang 38 Câu hỏi 3
Giải thích sự hình thành mưa acid từ sulfur dioxide.

Mưa acid là hiện tượng nước mưa có pH < 5,6.
Khi các khí sulfur dioxide, nitrogen dioxide bị oxi hóa và bị hòa tan trong nước tạo thành dung dịch acid HNO3 và H2SO4, làm nước mưa có độ pH < 5,6, gây nên mưa acid.

Với xúc tác là các ion kim loại trong khói bụi, SO2 bị oxi hóa và hòa tan trong nước mưa tạo thành sulfuric acid (H2SO4) gây ra mưa acid.
2SO2 + O2 + 2H2O → 2H2SO4
Câu hỏi trang 39 Câu hỏi 1
Em hãy tìm hiểu và đề xuất một số giải pháp phù hợp với lứa tuổi học sinh giúp giảm thiểu lượng sulfur dioxide thải vào không khí.

Nguồn phát thải sulfur dioxide trong khí quyển chủ yếu đến từ các hoạt động của con người (khí thải từ nhà máy điện sử dụng năng lượng hóa thạch, phương tiện giao thông,…). Để giảm thiểu lượng khí thải ta cần hạn chế sử dụng nhiên liệu hóa thạch, sử dụng nguồn năng lượng sạch thân thiện với môi trường.

Một số giải pháp phù hợp với lứa tuổi học sinh giúp giảm thiểu lượng sulfur dioxide thải vào không khí:
- Sử dụng tiết kiệm nhiên liệu khi đun nấu.
- Sử dụng, vẽ tranh tuyên truyền vận động mọi người sử dụng các nguồn nhiên liệu sinh học thân thiện với môi trường.
- Sử dụng, tuyên truyền vận động mọi người sử dụng các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió,…
- Sử dụng phương tiện công cộng.
Câu hỏi trang 39 Bài tập1
Tính chất nào sau đây không phải tính chất vật lý của sulfur?
A. Màu vàng ở điều kiện thường. B. Thể rắn ở điều kiện thường.
C. Không tan trong benzene. D. Không tan trong nước.

Sulfur là chất rắn màu vàng, không tan trong nước, tan nhiều trong dung môi hữu cơ.

Sulfur là chất rắn màu vàng, không tan trong nước, tan nhiều trong dung môi hữu cơ như: benzene, carbon disulfide,…
→ Chọn C.
Câu hỏi trang 39 Bài tập2
Số oxi hoá của sulfur trong phân tử SO2 là
A. +4 B. -2
C. +6 D. 0

Số oxi hóa là điện tích quy ước của nguyên tử và được tính theo các quy tắc xác định số oxi hóa:
- Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
- Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.
- Trong hợp chất, tổng số oxi hóa của nguyên tử trong phân tử bằng 0.
- Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.

Số oxi hóa của S trong SO2 là +4
→ Chọn A.
Câu hỏi trang 39 Bài tập3


Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.


Câu hỏi trang 39 Bài tập4
Khí SO2 do các nhà máy thải ra là nguyên nhân chính trong việc gây ô nhiễm môi trường. Theo quy chuẩn kỹ thuật quốc gia về chất lượng không khí xung quanh (QCVN 05:2013/BTNMT) thì nếu lượng SO2 vượt quá 350 µg/m3 không khí đo trong 1 giờ ở một thành phố thì coi như không khí bị ô nhiễm. Nếu người ta lấy 50 lít không khí trong 1 giờ ở một thành phố và phân tích thấy có 0,012 mg SO2 thì không khí ở đó có bị ô nhiễm không?

Sử dụng công thức tam suất thuận: nhân chéo chia ngang.

1 m3 = 1000 lít.
Trong 1 giờ, 50 lít không khí chứa 0,012 mg SO2
-> 1000 lít không khí chứa 1000 . 0,012/50 = 0,24 (mg) = 240 µg
Ở thành phố trên, 1m3 không khí chứa 240 µg SO2 (đo trong 1 giờ). Do đó không khí của thành phố này không bị ô nhiễm.
