Câu hỏi trang 39 Mở đầu
|
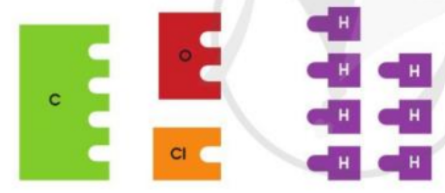
Cho các miếng bìa ghi kí hiệu hóa học của các nguyên tố C, O, Cl, H như hình dưới đây. Mỗi miếng bìa tượng trưng cho một nguyên tử. Hãy ghép các miếng bìa H với các miếng bìa khác sao cho phù hợp. Hãy cho biết mỗi nguyên tử C, O, Cl ghép được với tối đa bao nhiêu nguyên tử H. Dùng kí hiệu hóa học và các chữ số để mô tả trong những miếng ghép thu được có bao nhiêu nguyên tử của mỗi nguyên tố
|

- 1 nguyên tử C ghép được tối đa 4 nguyên tử H => CH4
- 1 nguyên tử O ghép được tối đa 2 nguyên tử H => H2O
- 1 nguyên tử Cl ghép được tối đa 1 nguyên tử H => HCl
Câu hỏi trang 39 Câu hỏi
|
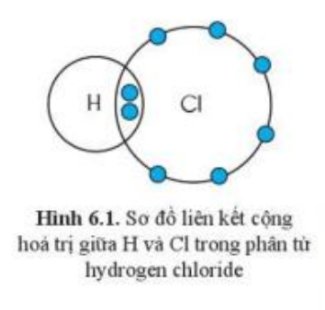
Quan sát hình 6.1, hãy so sánh hóa trị của nguyên tố và số electron mà nguyên tử của nguyên tố đã góp chung để tạo ra liên kết
|

H và Cl đều có hóa trị I

- Trong hình 6.1, mỗi nguyên tử H và Cl góp 1 electron tạo ra đôi electron dùng chung giữa 2 nguyên tử
- H và Cl đều có hóa trị I
=> Hóa trị của nguyên tố = số electron mà nguyên tử của nguyên tố đã góp chung để tạo ra liên kết
Câu hỏi trang 40 Luyện tập
|
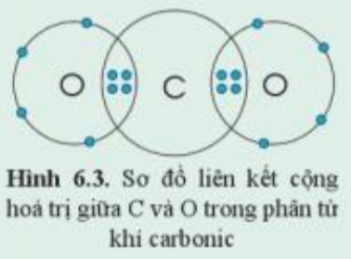
Quan sát hình 6.3 và xác định hóa trị của C và O trong khí carbonic
|

Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác

- Mỗi nguyên tử O góp chung 2 electron
- Nguyên tử C góp chung 4 electron
=> Nguyên tử C liên kết với 2 nguyên tử O bằng 4 cặp đôi electron chung
=> C có hóa trị IV và O có hóa trị II
Câu hỏi trang 40 Luyện tập
|
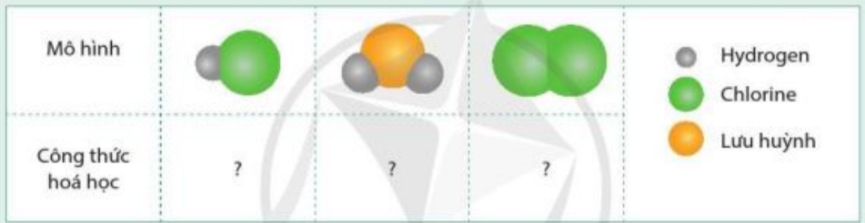
Vẽ sơ đồ hình thành liên kết giữa nguyên tử N và ba nguyên tử H. Hãy cho biết liên kết đó thuộc loại liên kết nào. Hóa trị của mỗi nguyên tố trong hợp chất tạo thành là bao nhiêu? |

- Nguyên tử N có 5 electron ở lớp ngoài cùng => Cần thêm 3 electron để đạt cấu hình electron của khí hiếm Ne
- Nguyên tử H có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron để đạt cấu hình electron của khí hiếm He
- Trong hợp chất cộng hóa trị, hóa trị của nguyên tố = số electron mà nguyên tử nguyên tố đó góp chung với nguyên tử khác

- Nguyên tử N có 5 electron ở lớp ngoài cùng => Cần thêm 3 electron để đạt cấu hình electron của khí hiếm Ne
- Nguyên tử H có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron để đạt cấu hình electron của khí hiếm He
=> Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung
=> Sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và N:
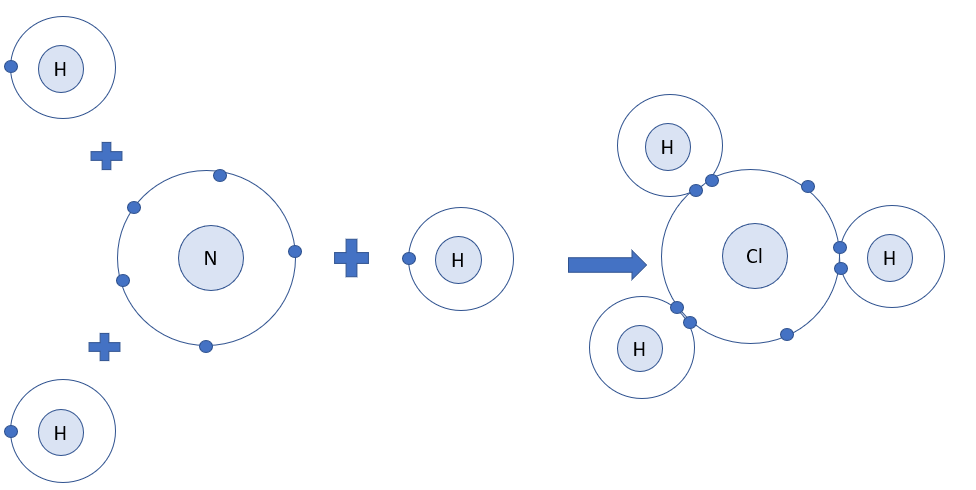
=> Hợp chất NH3 là liên kết cộng hóa trị
- Mỗi nguyên tử H góp chung 1 electron, nguyên tử N góp chung 3 electron
=> H có hóa trị I, N có hóa trị III
Câu hỏi trang 41 Câu hỏi
|
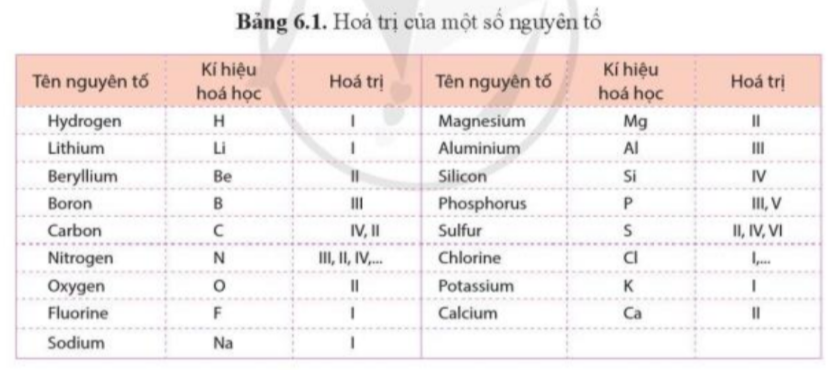
Cát được sử dụng nhiều trong xây dựng và là nguyên liệu chính để sản xuất thủy tinh. Silicon oxide là thành phần chính của cát. Phân tử silicon oxide gồm 1 nguyên tử Si liên kết với 2 nguyên tử O. Dựa vào hóa trị của các nguyên tố trong bảng 6.1, hãy tính tích hóa trị và số nguyên tử của mỗi nguyên tố trong phân tử silicon oxide và nhận xét về tích đó.
|

Quy tắc hóa trị: Khi các nguyên tử của 2 nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B

|
Nguyên tố |
Si |
O |
|
Hóa trị |
IV |
II |
|
Số nguyên tử |
1 |
2 |
|
Tích hóa trị và số nguyên tử |
IV x 1 = II x 2 |
|
=> Tích hóa trị và số nguyên tử của nguyên tố Si = tích hóa trị và số nguyên tử của nguyên tố O
Câu hỏi trang 41 Luyện tập
|
1. Dựa vào hóa trị của các nguyên tố trong bảng 6.1 và quy tắc hóa trị, hãy cho biết mỗi nguyên tử Mg có thể kết hợp được với bao nhiêu nguyên tử Cl.
2. Nguyên tố A có hóa trị III, nguyên tố B có hóa trị II. Hãy tính tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ 2 nguyên tố đó. |

1.
Quy tắc hóa trị: Khi các nguyên tử của 2 nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B
2.
Bước 1: Gọi số nguyên tử của nguyên tố A, B lần lượt là x và y
Bước 2: Áp dụng quy tắc hóa trị
Bước 3: Tính tỉ lệ

1.
- Gọi số nguyên tử của nguyên tố Mg (II), Cl (I) lần lượt là x và y
- Áp dụng quy tắc hóa trị ta có: II.x = I.y

2.
- Gọi số nguyên tử của nguyên tố A (III), B (II) lần lượt là x và y

Câu hỏi trang 41 Câu hỏi
|
Cho công thức hóa học của một số chất như sau: a) N2 (nitrogen) b) NaCl (sodium chloride) c) MgSO4 (magnesium sulfate) Xác định nguyên tố tạo thành mỗi chất và số nguyên tử của mỗi nguyên tố có trong phân tử |


- Công thức hóa học gồm 2 phần:
+ Phần chữ: kí hiệu hóa học của các nguyên tố tạo thành chất
+ Phần số: số được ghi dưới chân kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong 1 phân tử

a) N2: Nguyên tố tạo thành là N, có 2 nguyên tử N
b) NaCl gồm:
+ Nguyên tố Na, có 1 nguyên tử Na
+ Nguyên tố Cl, có 1 nguyên tử Cl
c) MgSO4 gồm:
+ Nguyên tố Mg, có 1 nguyên tử Mg
+ Nguyên tố S, có 1 nguyên tử S
+ Nguyên tố O, có 4 nguyên tử O
Câu hỏi trang 42 Luyện tập
|
Viết công thức hóa học của các chất: a) Sodium sulfide, biết trong phân tử có 2 nguyên tử Na và 1 nguyên tử S b) Phosphoric acid, biết trong phân tử có 3 nguyên tử H, 1 nguyên tử P và 4 nguyên tử O |

- Phần chữ: kí hiệu hóa học của các nguyên tố tạo thành chất
- Phần số: số được ghi dưới chân (bên phải) kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong 1 phân tử

a) Sodium sulfide: 2 nguyên tử Na, 1 nguyên tử S
=> Na2S
b) Phosphoric acid: 3 nguyên tử H, 1 nguyên tử P, 4 nguyên tử O
=> H3PO4
Câu hỏi trang 42 Luyện tập
|
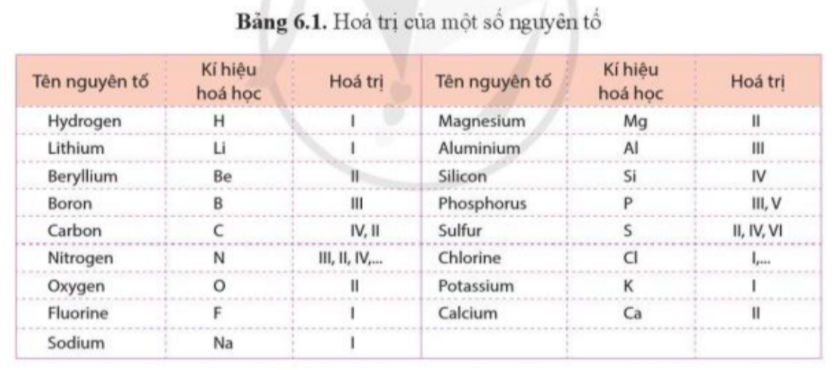
Viết công thức hóa học cho các chất được biểu diễn bằng những mô hình sau. Biết mỗi quả cầu biểu diễn cho 1 nguyên tử
|

- Phần chữ: kí hiệu hóa học của các nguyên tố tạo thành chất
- Phần số: số được ghi dưới chân (bên phải) kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong 1 phân tử
+ Hydrogen: H
+ Chlorine: Cl
+ Lưu huỳnh: S

Advertisements (Quảng cáo)
- Mô hình 1: 1 nguyên tử H, 1 nguyên tử Cl => HCl
- Mô hình 2: 2 nguyên tử H, 1 nguyên tử S => H2S
- Mô hình 3: 2 nguyên tử Cl => Cl2
Câu hỏi trang 42 Luyện tập
|
Đường glucose là nguồn cung cấp năng lượng quan trọng cho hoạt động sống của con người. Đường glucose có công thức hóa học là C6H12O6. Hãy cho biết: a) Glucose được tạo thành từ những nguyên tố nào? b) Khối lượng mỗi nguyên tố trong 1 phân tử glucose là bao nhiêu? c) Khối lượng phân tử glucose là bao nhiêu? |

a) Phần chữ của công thức hóa học: kí hiệu hóa học của các nguyên tố tạo thành chất
b) Khối lượng mỗi nguyên tố = khối lượng nguyên tử x chỉ số của nguyên tố đó
c) Khối lượng phân tử = tổng khối lượng của các nguyên tố tạo nên phân tử

a) Glucose được tạo thành từ những nguyên tố: C, H và O
b)
- Nguyên tố C: Có 6 nguyên tử C (khối lượng nguyên tử: 12 amu)
=> Khối lượng nguyên tố C trong 1 phân tử glucose = 12 amu x 6 = 72 amu
- Nguyên tố H: Có 12 nguyên tử H (khối lượng nguyên tử: 1 amu)
=> Khối lượng nguyên tố H trong 1 phân tử glucose = 1 amu x 12 = 12 amu
- Nguyên tố O: Có 6 nguyên tử O (khối lượng nguyên tử: 16 amu)
=> Khối lượng nguyên tố O trong 1 phân tử glucose = 16 amu x 6 = 96 amu
c)
Khối lượng phân tử glucose = khối lượng nguyên tố C + khối lượng nguyên tố H + khối lượng nguyên tố O
= 72 amu + 12 amu + 96 amu = 180 amu
Câu hỏi trang 43 Câu hỏi
|
Có ý kiến cho rằng: Trong nước, số nguyên tử H gấp 2 lần số nguyên tử O nên phần trăm khối lượng của H trong nước gấp 2 lần phần trăm khối lượng O. Theo em, ý kiến trên có đúng không? Hãy tính phần trăm khối lượng của H, O trong nước để chứng minh |

Bước 1: Tính khối lượng mỗi nguyên tố có trong 1 phân tử hợp chất
Bước 2: Tính khối lượng phân tử
Bước 3: Tính phần trăm khối lượng của nguyên tố theo công thức:


Trong phân tử nước gồm: 1 nguyên tử O và 2 nguyên tử H
Ta có: Khối lượng của nguyên tố O trong nước là:
mO = 1 x 16 amu = 16 amu
Khối lượng của nguyên tố H trong nước là:
mH = 2 x 1 amu = 2 amu
=> Khối lượng phân tử nước là: Mnước = 16 + 2 = 18 amu
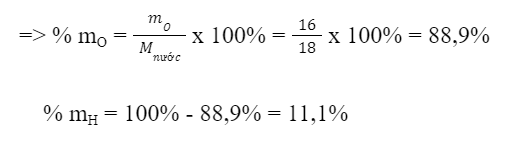
=> Ý kiến: Phần trăm khối lượng của H trong nước gấp 2 lần phần trăm khối lượng O là sai
Câu hỏi trang 43 Luyện tập
|
1. Calcium carbonate là thành phần chính của đá vôi, có công thức hóa học là CaCO3. Tính phần trăm khối lượng của mỗi nguyên tố trong hợp chất trên 2. Citric acid là hợp chất được sử dụng nhiều trong công nghiệp thực phẩm, dược phẩm. Trong tự nhiên, citric acid có trong quả chanh và một số loại quả như bưởi, cam,… Citric acid có công thức hóa học là C6H8O7. Hãy tính phần trăm khối lượng của mỗi nguyên tố trong citric acid |

Bước 1: Tính khối lượng mỗi nguyên tố có trong 1 phân tử hợp chất
Bước 2: Tính khối lượng phân tử
Bước 3: Tính phần trăm khối lượng của nguyên tố theo công thức:


1. Calcicum carbonate gồm: 1 nguyên tử Ca, 1 nguyên tử C và 3 nguyên tử O
Ta có: Khối lượng của nguyên tố Ca trong CaCO3 là:
mCa = 1 x 40 amu = 40 amu
Khối lượng của nguyên tố C trong CaCO3 là:
mC = 1 x 12 amu = 12 amu
Khối lượng của nguyên tố O trong CaCO3 là:
mO = 3 x 16 amu = 48 amu
=> Khối lượng phân tử CaCO3 là: MCaCO3 = 40 + 12 + 48 = 100 amu
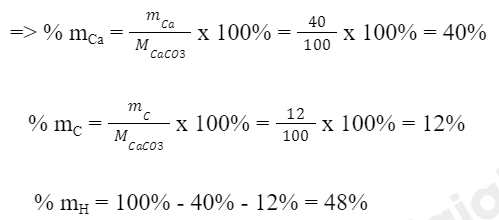
2. Citric acid gồm: 6 nguyên tử C, 8 nguyên tử H và 7 nguyên tử O
Ta có: Khối lượng của nguyên tố C trong C6H8O7 là:
mC = 6 x 12 amu = 72 amu
Khối lượng của nguyên tố H trong C6H8O7 là:
mH = 1 x 8 amu = 8 amu
Khối lượng của nguyên tố O trong C6H8O7 là:
mO = 7 x 16 amu = 112 amu
=> Khối lượng phân tử C6H8O7 là: MC6H8O7 = 72 + 8 + 112 = 192 amu

Câu hỏi trang 43 Vận dụng
|
Potassium rất cần thiết cho cây trồng, đặc biệt trong giai đoạn cây trưởng thành, ra hoa, kết trái. Để cung cấp K cho cây có thể sử dụng phân potassium chloride và potassium sulfate có công thức hóa học lần lượt là KCl và K2SO4. Người trồng cây muốn sử dụng loại phân bón có hàm lượng K cao hơn thì nên chọn loại phân bón nào? |

Tính phần trăm của K trong 2 hợp chất là KCl và K2SO4
Bước 1: Tính khối lượng nguyên tố K có trong 1 phân tử hợp chất
Bước 2: Tính khối lượng phân tử
Bước 3: Tính phần trăm khối lượng của nguyên tố theo công thức:


- Xét hợp chất KCl:
Ta có: Khối lượng của nguyên tố K trong KCl là:
mK = 1 x 39 amu = 39 amu
Khối lượng phân tử KCl là: MKCl = 1 x 39 amu + 1 x 35,5 amu = 74,5 amu
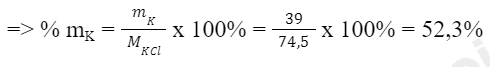
- Xét hợp chất K2SO4:
Ta có: Khối lượng của nguyên tố K trong K2SO4 là:
mK = 2 x 39 amu = 78 amu
Khối lượng phân tử K2SO4 là: MK2SO4 = 2 x 39 amu + 1 x 32 amu + 4 x 16 amu = 174 amu
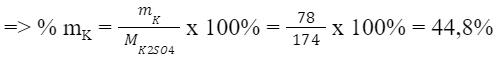
=> Hàm lượng K trong KCl nhiều hơn trong K2SO4
=> Người trồng muốn sử dụng loại phân bón có hàm lượng K cao hơn thì nên chọn phân bón potassium sulfate
Câu hỏi trang 44 Luyện tập
|
Xác định hóa trị của mỗi nguyên tố trong các hợp chất sau: HBr, BaO |

Bước 1: Đặt hóa trị của nguyên tố chưa biết là a
Bước 2: Xác định a dựa vào quy tắc hóa trị

- Xét hợp chất HBr:
+ Gọi hóa trị của Br trong hợp chất là a
+ Vì H có hóa trị I nên ta có biểu thức:
a x 1 = I x 1 => a = I
=> Vậy H có hóa trị I và Br có hóa trị I
- Xét hợp chất BaO
+ Gọi hóa trị của Ba trong hợp chất là a
+ Vì O có hóa trị II nên ta có biểu thức:
a x 1 = II x 1 => a = II
=> Vậy O có hóa trị II và Ba có hóa trị II
Câu hỏi trang 45 Luyện tập
|
Hợp chất X được tạo thành bởi Fe và O có khối lượng phân tử là 160. Biết phần trăm khối lượng của Fe trong X là 70%. Hãy xác định công thức hóa học của X |

Bước 1: Đặt công thức hóa học của chất là FexOy
Bước 2: Tính khối lượng của Fe và O trong 1 phân tử chất
Bước 3: Tìm x, y

Đặt công thức hóa học của X là FexOy
Khối lượng của nguyên tố Fe trong 1 phân tử X là:

Khối lượng của nguyên tố O trong 1 phân tử X là:
160 – 112 = 48 amu
Ta có: 56 amu . x = 112 amu => x = 2
16 amu . y = 48 amu => y = 3
Vậy công thức hóa học của X là Fe2O3