Câu hỏi trang 26 MĐ
|
Cho biết sự phân bố electron theo lớp của các nguyên tử H, He, Li như sau: Dựa vào hình 5.1, hãy cho biết số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z $ \geqslant $ 2 là bao nhiêu. Theo em, thứ tự phân bố electron vào lớp vỏ nguyên tử như thế nào? |

Số electron tối đa trong mỗi lớp là 2n2(n là số thứ tự lớp n $ \leqslant $ 4).

- Số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z $ \geqslant $ 2 là 2.
- Thứ tự phân bố electron vào lớp vỏ nguyên tử
+ Các electron được phân bố vào lớp gần hạt nhân trước.
+ Số electron tối đa trong mỗi lớp là 2n2(n là số thứ tự lớp n $ \leqslant $ 4).
Câu hỏi trang 26
|
1. Vì sao số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó? |

- Lớp thứ n có n2 AO.
- Lớp thứ n có tối đa 2n2 electron.

Vì lớp thứ n có n2 AO và số electron tối đa trong mỗi lớp là 2n2 nên số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó.
Câu hỏi trang 27 Luyện tập
|
1. Lớp ngoài cùng của nitrogen (Z = 7) có bao nhiêu electron, bao nhiêu AO? |


N (Z = 7)
+ Lớp K có 2 electron.
+ Lớp L có 5 electron.
⇒ Lớp ngoài cùng có 5 electron và 3 AO.
Câu hỏi trang 27
|
2. Các ô (1), (2), (3), (4) trong hình dưới đây liên hệ với nội dung nào về cấu tạo lớp vỏ nguyên tử? |

Lớp electron thứ n có n phân lớp:
+ n = 1, lớp K: có 1 phân lớp (1s).
+ n = 2, lớp L: có 2 phân lớp (2s và 2p).
+ n = 3, lớp M: có 3 phân lớp (3s, 3p và 3d).
+ n = 4, lớp N: có 4 phân lớp (4s, 4p, 4d, 4f).

Ô (1): Lớp K.
Ô (2): Lớp L.
Ô (3): Lớp M.
Ô (4): Lớp N.
Câu hỏi 3 trang 27
|
3. Lớp electron thứ tư (n = 4) có bao nhiêu phân lớp và kí hiệu các phân lớp này là gì? |

Lớp electron thứ n có n phân lớp:
+ n = 1, lớp K: có 1 phân lớp (1s).
+ n = 2, lớp L: có 2 phân lớp (2s và 2p).
+ n = 3, lớp M: có 3 phân lớp (3s, 3p và 3d).
+ n = 4, lớp N: có 4 phân lớp (4s, 4p, 4d, 4f).

Lớp electron thứ tư (n = 4) có 4 phân lớp và kí hiệu là 4s, 4p, 4d, 4f.
Câu hỏi 4 trang 27
|
4. Tính số electron tối đa (bão hòa) trên mỗi phân lớp ns, np, nd, nf. |

- Số lượng AO trong mỗi phân lớp:
+ Phân lớp ns chỉ có 1 AO.
+ Phân lớp np có 3 AO.
+ Phân lớp nd có 5 AO.
+ Phân lớp nf có 7 AO.
- Số electron tối đa trong mỗi AO luôn gấp 2 lần số AO.

Câu hỏi 2 trang 28 Luyện tập
|
2. Viết cấu hình electron của các nguyên tố có số hiệu nguyên tử từ 1 đến 20 |

- Điền electron theo thứ tự mức năng lượng từ thấp đến cao (dãy Klechkovski):
1s, 2s, 2p, 3s, 4s, 3d, 4p, 5s, 4d, 5p, 6s, …
Điền electron bão hòa phân lớp trước rồi mới điền tiếp vào phân lớp sau.
- Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần từ trái qua phải
Advertisements (Quảng cáo)
1s, 2s, 2p, 3s, 3d, 4s, 4p, 4d, …
Chú ý: Số electron tối đa của mỗi phân lớp.

Z = 1: 1s1
Z = 2: 1s2
Z = 3: 1s22s1
Z = 4: 1s22s2
Z = 5: 1s22s22p1
Z = 6: 1s22s22p2
Z = 7: 1s22s22p3
Z = 8: 1s22s22p4
Z = 9: 1s22s22p5
Z = 10: 1s22s22p6
Z = 11: 1s22s22p63s1
Z = 12: 1s22s22p63s2
Z = 13: 1s22s22p63s23p1
Z = 14: 1s22s22p63s23p2
Z = 15: 1s22s22p63s23p3
Z = 16: 1s22s22p63s23p4
Z = 17: 1s22s22p63s23p5
Z = 18: 1s22s22p63s23p6
Z = 19: 1s22s22p63s23p64s1
Z = 20: 1s22s22p63s23p64s2
Câu hỏi 3 trang 29 Luyện tập
|
3. Biểu diễn cấu hình theo ô orbital (chỉ với lớp ngoài cùng) các nguyên tử có Z từ 1 đến 20. Xác định số electron độc thân của mỗi nguyên tử. |

Chú ý:
+ Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp.Chú ý:
+ Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất.
+ Electron được điền từ trái sang phải.
+ Trong mỗi ô, electron đầu tiên được biểu diễn bằng ↑, electron thứ hai được biểu diễn bằng ↓.

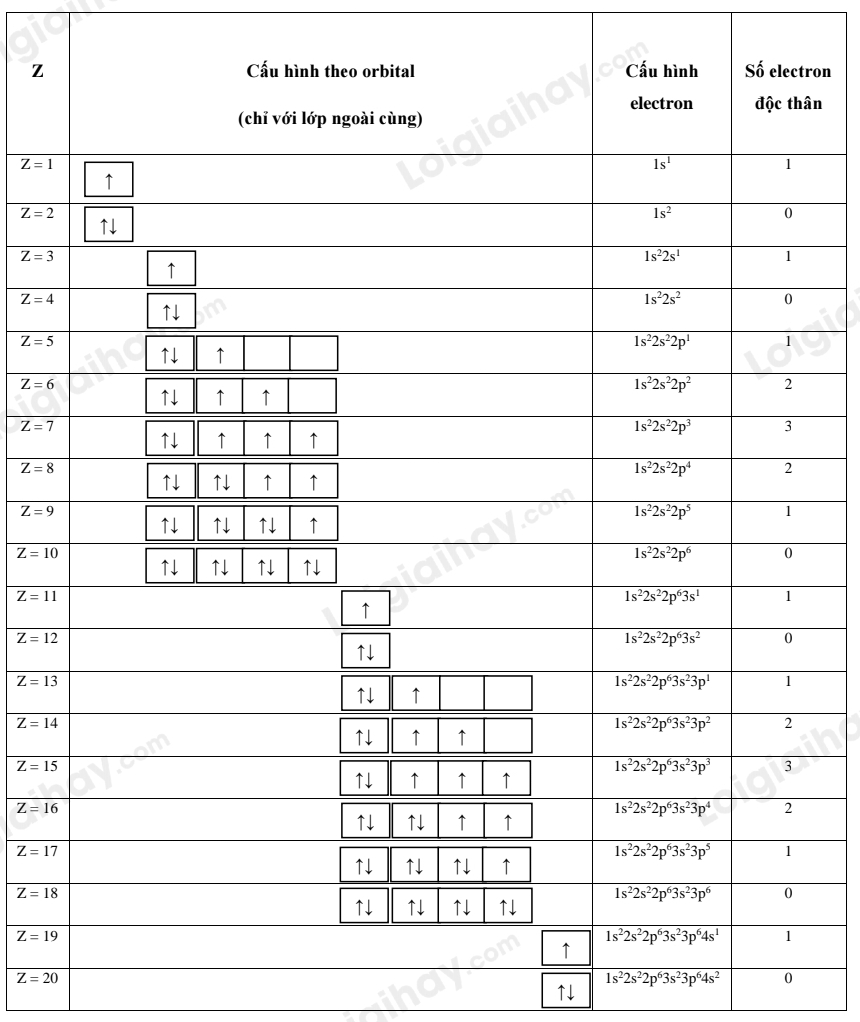
Câu hỏi 4 trang 30 Luyện tập
|
4. Dự đoán tính chất hóa học cơ bản (tính kim loại, tính phi kim) của các nguyên tố có Z từ 1 đến 20. |

Từ cấu hình electron, có thể dự đoán các tính chất theo quy tắc sau:
Các nguyên tử có … electron ở lớp ngoài cùng
+ 1, 2, 3: nguyên tố kim loại (tính khử).
+ 5, 6, 7: nguyên tố phi kim (tính oxi hóa).
+ 8: nguyên tố khí hiếm (trừ He chỉ có 2 electron).
+ 4: nguyên tố kim loại hoặc phi kim.

Giải bài 1,2,3 trang 30 SGK hóa 10 chân trời sáng tạo
|
Bài 1: Những phát biểu nào sau đây là đúng? (a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi. (b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s. (c) Trong một nguyên tử, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p. (d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần năng lượng của electron thuộc AO 2p. |

- AO s (AO hình cầu), AO p (AO hình số tám nổi).
- Các electron thuộc cùng một phân lớp có năng lượng bằng nhau, các electron thuộc cùng một lớp có năng lượng gần bằng nhau.

(a) Sai vì AO s có dạng hình cầu.
(b) Đúng.
(c) Sai.
(d) Đúng.
|
Bài 2: Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Vậy X có thể là những nguyên tố nào? |

X có hai lớp electron và có một electron độc thân
X có thể là Li (Z = 3):1s22s1 hoặc F (Z = 9): 1s22s22p5.
|
Bài 3*: Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng. a) Viết cấu hình electron của Na+ và Cl-. b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron? |

a) Na (Z = 11) 1s22s22p63s1 ⇒ Na+: 1s22s22p6.
Cl (Z = 17) 1s22s22p63s23p5 ⇒ Cl-: 1s22s22p63s23p6.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp p của Cl. AO đó là AO chứa 1 electron.
