Câu hỏi/bài tập:
Cho các nguyên tố sau: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Hãy sắp xếp các nguyên tố trên theo chiều giảm dần bán kính nguyên tử.

- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim để xác định đáp án đúng

- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
+ Nguyên tố N có Z = 7 => Cấu hình electron của N là: 1s22s22p3
=> N thuộc chu kì 2, nhóm VA
+ Nguyên tố Mg có Z = 12 => Cấu hình electron của Mg là: 1s22s22p63s2
Advertisements (Quảng cáo)
=> Mg thuộc chu kì 3, nhóm IIA
+ Nguyên tố Si có Z = 14 => Cấu hình electron của Si là: 1s22s22p63s23p2
=> Si thuộc chu kì 3, nhóm IVA
+ Nguyên tố K có Z = 19 => Cấu hình electron của K là: 1s22s22p63s23p64s1
=> K thuộc chu kì 4, nhóm IA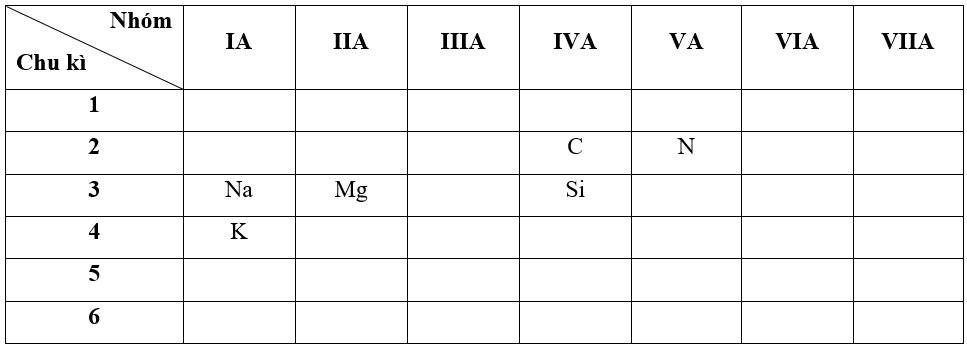
- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử:
Do nguyên tố K và Mg không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là Na (Na cùng chu kì với Mg và cùng nhóm với K)
+ Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: K > Na (1)
+ Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: Na > Mg > Si (2)
Do nguyên tố Si và N không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là C (C cùng chu kì với N và cùng nhóm với Si)
+ Trong cùng một nhóm IVA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: Si > C (3)
+ Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: C > N (4)
=> Từ (1), (2), (3) và (4) ta có dãy sắp xếp theo chiều giảm dần bán kính nguyên tử:
K > Mg > Si > N
