Câu hỏi/bài tập:
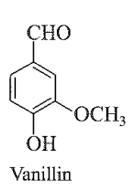
Đề bài: Trong vỏ quả cây vanilla có hợp chất mùi thơm dễ chịu, tên thường là vanillin. Công thức cấu tạo của vanillin là:
a) Viết công thức phân tử của vanillin.
b) Dự đoán khả năng tan trong nước, trong ethanol và trong dung dịch kiềm như NaOH, KOH của vanillin.
c) Mẫu vanillin đủ tiêu chuẩn dùng trong công nghiệp sản xuất dược phẩm và thực phẩm cần có trên 99% về khối lượng là vanillin. Để định lượng một mẫu vanillin, người ta làm như sau: Hoà tan 0,120 gam mẫu trong 20ml ethanol 96% và thêm 60ml nước cất, thu được dung dịch X . Biết X phản ứng vừa đủ với 7,82ml dung dịch nồng độ 0,1M và tạp chất trong mẫu không phản ứng với NaOH . Mẫu vanillin trên có đủ tiêu chuẩn dùng trong công nghiệp sản xuất dược phẩm và thực phẩm không?

Advertisements (Quảng cáo)
Từ công thức cấu tạo đưa ra công thức phân tử và tính chất của hợp chất.

a) Công thức phân tử của vanillin: C8H8O3 b) Vanillin khó tan trong nước, dễ tan trong ethanol, tan trong dung dịch kiềm do có nhóm OH phenol. c) Số mol NaOH là: \(\frac{{7,82.0,1}}{{1000}}.108 = {7,82.10^{ - 4}}\) mol
HO – C6H3(OCH3)(CHO) + NaOH => NaO – C6H3(OCH3)(CHO) + H2O
n C8H8O3 = n NaOH = 7,82 . 10-4 Phần trăm khối lượng vanillin trong mẫu trên là:
\(\frac{{{{7,82.10}^{ - 4}}.152}}{{0,12}}.100\% = 99,05\% \)
Vậy mẫu vanillin trên đủ tiêu chuẩn dùng trong công nghiệp sản xuất dược phẩm và thực phẩm.
