Câu hỏi/bài tập:
8 a) Viết cấu hình electron của nguyên tử nitrogen (\(_7N\)) theo ô orbital. Nguyên tử N có bao nhiêu electron hóa trị ghép đôi, bao nhiêu electron độc thân?
b) Có hai đề xuất về công thức Lewis của phân tử HNO3 như bên:
b1) Công thức (A) hay (B) phù hợp với đặc điểm của electron hóa trị của nguyên tử nitrogen? Theo công thức đó, hóa trị và số oxi hóa của N là bao nhiêu?
b2) Kết quá nghiên cứu cho biết giá trị độ dài của liên kết giữa nguyên tử N và O (liên kết NO) trong phân tử HNO3 là 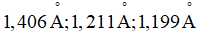 Công thức (A) hay (B) có thể thỏa mãn các số liệu đã cho? Giải thích.
Công thức (A) hay (B) có thể thỏa mãn các số liệu đã cho? Giải thích.

Dựa vào cấu hình electron của nitrongen
Advertisements (Quảng cáo)

a) \(_7N\):
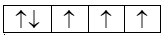
Nguyên tử N có 1 cặp electron hóa trị ghép đôi, 3 electron hóa trị độc thân
b) b1) Công thức (A) phù hợp hơn vì nguyên tử N chỉ có 4 orbital hóa trị, do đó chỉ có thể tạo tối đa 4 liên kết cộng hóa trị. Theo công thức (A), N có hóa trị IV và số oxi hóa là +5.
b2) Công thức (A) phù hợp với dữ liệu do có ba loại liên kết giữa N và O không tương đương nhau trong phân tử HNO3 (1 liên kết đôi, 1 liên kết đơn theo kiểu ghép đôi electron hóa trị và 1 liên kết đơn theo kiểu cho – nhận)
