1. Viết cấu hình electron của nguyên tử S (Z = 16) và biểu diễn sự phân bố electron vào các ô orbital.
2. Dựa vào cấu hình elecron và độ âm điện của nguyên tử S, hãy đưa ra dự đoán về:
a) Số oxi hoá thấp nhất, cao nhất của nguyên tử S trong hợp chất.
b) Tính oxi hoá, tính khử của sulfur.

1. Che nguyên tử sulfur: 1s22s22p63s23p4.
2. a) Trong hợp chất, số oxi hoá thấp nhất của S là -2; số oxi hoá cao nhất của S là +6.
b) S có khả năng thể hiện cả tính oxi hóa lẫn tính khử.
Advertisements (Quảng cáo)

1. Cấu hình electron của nguyên tử sulfur là: 1s22s22p63s23p4.
Cấu hình electron theo ô orbital:
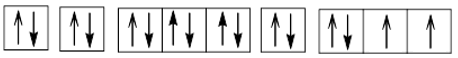
2. a) Ở trạng thái cơ bản S có 2 electron độc thân; ở trạng thái kích thích S có 4 hoặc 6 electron độc thân. Bởi vậy, trong hợp chất của S với các nguyên tố có độ âm điện nhỏ hơn S có số oxi hoá -2; trong các hợp chất cộng hoá trị của S với các nguyên tố có độ âm điện lớn hơn, nguyên tố S có số oxi hoá +4 hoặc +6.
⇒ Trong hợp chất, số oxi hoá thấp nhất của S là -2; số oxi hoá cao nhất của S là +6.
b) Khi tham gia phản ứng hoá học S thể hiện tính oxi hoá hoặc tính khử do đơn chất S (số oxi hoá = 0) có số oxi hoá trung gian giữa -2 và +6.
