Câu hỏi trang 43
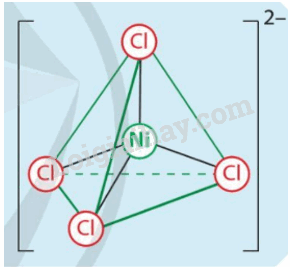
Bằng thực nghiệm, người ta xác định được cấu tạo của phức chất [NiCl4]2- như hình bên. Hãy cho biết:
a) Dạng hình học của phức chất.
b) Thuyết Liên kết hóa trị giải thích dạng hình học của phức chất [NiCl4]2- như thế nào?

Dựa vào liên kết và cấu tạo của phức chất.

a) Dạng tứ diện.
b) Nguyên tử Ni sử dụng một số orbital trống để tổ hợp và tạo thành các orbital lai hóa, phân tử hoặc anion Cl- cho cặp electron chưa liên kết vào các orbital lai hóa trống của nguyên tử Ni để hình thành liên kết cho nhân.
Câu hỏi trang 44
Xác định điện tích của nguyên tử trung tâm trong phức chất [Cd(NH3)4]2+.

Dựa vào liên kết và cấu tạo phức chất theo thuyết liên kết hóa trị.

Phức chất có điện tích là +2, mỗi phân tử NH3 có điện tích bằng 0 nên điện tích của cation kim loại tạo nguyên tử trung tâm là +2.
Câu hỏi trang 45 Luyện tập (LT) 1
Thực nghiệm xác nhận phức chất [Zn(NH3)4]2+ có dạng hình học tứ diện. Giải thích sự hình thành liên kết và mô tả cấu tạo của phức chất này theo thuyết Liên kết hóa trị.

Dựa vào liên kết và cấu tạo phức chất theo thuyết liên kết hóa trị.

Thuyết liên kết hóa trị giải thích dạng hình học của phức chất [Zn(NH3)4]2+ như sau:
Phức chất có điện tích là +2, mỗi phân tử NH3 trung hoà về điện (có điện tích là 0), vậy điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Zn2+ là: [Ar]3d104s04p0.
Cấu hình electron hoá trị dạng ô orbital của Zn2+ là:
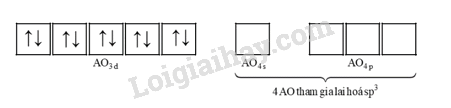
Cation Zn2+ sử dụng 1 orbital 4s trống và 3 orbital 4p trống để lai hoá sp3, tạo nên 4 orbital lai hoá trống.
Mỗi phân tử NH3 cho mỗi orbital lai hoá trống của cation Zn2+ một cặp electron chưa liên kết để hình thành một liên kết cho – nhận.
Câu hỏi trang 45 Luyện tập (LT) 2
Thực nghiệm xác nhận phức chất [FeF6]4- có dạng hình học bát diện. Giải thích sự hình thành liên kết và mô tả cấu tạo của phức chất này theo thuyết Liên kết hóa trị.

Dựa vào liên kết và cấu tạo của phức chất.

Phức chất có điện tích là – 4, mỗi ion F- có điện tích là – 1 nên điện tích của cation nguyên tử trung tâm là +2.
Cấu hình electron của Fe2+: [Ar]3d6
Orbital ion Fe2+ là:
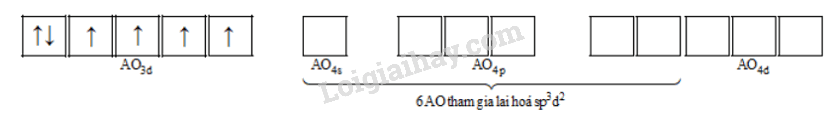
Để tạo ra dạng hình học bát diện, nguyên tử trung tâm Fe2+ lai hoá sp3d2 , 6 phối tử F- cho cặp electron chưa liên kết vào 6 orbital lai hoá sp3d2 trống của Fe2+ tạo thành 6 liên kết.
Câu hỏi trang 46 Luyện tập (LT) 1
Theo thực nghiệm, phức chất [Fe(CN)6]3- có dạng hình học bát diện. Hãy vẽ dạng hình học của phức chất này.

Dựa vào dạng hình học phổ biến của phức chất

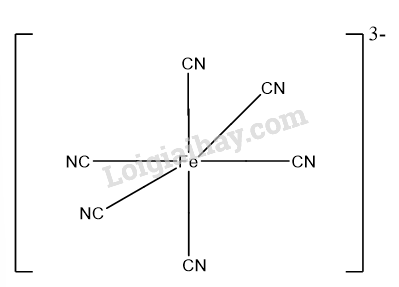
Câu hỏi trang 46 Luyện tập (LT) 2
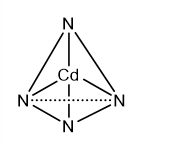
Thực nghiệm xác nhận phức chất [Cd(NH3)4]2+ có dạng hình học tứ diện. Hãy vẽ dạng hình học của phức chất này.
Advertisements (Quảng cáo)

Dựa vào dạng hình học phổ biến của phức chất.

Câu hỏi trang 46 Luyện tập (LT) 3
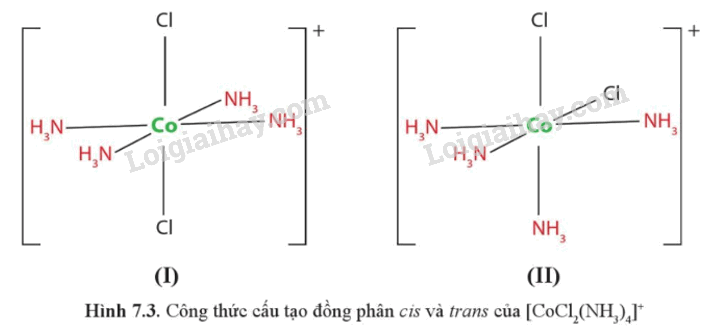
Chỉ ra đồng phân cis và trans của phức chất bát diện [CoCl2(NH3)4]+ ở hình 7.3

Dựa vào đồng phân phức chất.

Hình (I) là đồng phân cis, Hình (II) là đồng phân trans.
Câu hỏi trang 47
Vì sao nguyên tử N và một nguyên tử O trong anion \(NO_2^ - \)đều có thể tạo liên kết cho – nhận với nguyên tử trung tâm như trong phức chất (III) hoặc (IV)?

Dựa vào đồng phân liên kết.

Vì nguyên tử N hay O đều có thể liên kết với nguyên tử Co2+ cặp electron liên kết.
Câu hỏi trang 48 Luyện tập (LT)
Hãy cho biết hai phức chất dưới đây có phải là đồng phân của nhau không. Giải thích.
[PtCl2(NH3)4]Br2 và [PtBr2(NH3)4]Cl2.

Dựa vào đồng phân liên kết.

Hai phức chất là đồng phân của nhau. Do có sự hoán đổi vị trí của Cl và Br.
Phức chất [CoCl4]2- có dạng hình học tứ diện. Giải thích sự tạo thành liên kết và vẽ dạng hình học của phức chất này theo thuyết Liên kết hóa trị.

Dựa vào thuyết Liên kết hóa trị.

Nguyên tử trung tâm: Co2+, số phối trí của nguyên tử trung tâm: 4
Nguyên tử trung tâm là Co2+ có cấu hình [Ar]3d8. Để tạo ra dạng hình học tứ diện thì nguyên tử trung tâm Ni2+ lai hoá sp3, bốn phối tử Cl cho cặp electron chưa liên kết của nguyên tử Cl vào bốn orbital lai hoá sp3 trống của Co2+, tạo thành bốn liên kết.
Phức chất [Co(OH2)6]2+ có dạng hình học bát diện. Giải thích sự tạo thành liên kết và vẽ dạng hình học của phức chất này theo thuyết Liên kết hóa trị.

Dựa vào thuyết Liên kết hóa trị.

Cation Co2+ sử dụng 1 orbital 4s trống, 3 orbital 4p trống và 2 orbital 4d trống để lai hóa sp3d2, tạo nên 6 orbital lai hóa trống.
Mỗi phân tử H2O cho mỗi orbital lai hóa trống của cation Co2+ một cặp electron chưa liên kết để hình thành 1 liên kết cho – nhận.
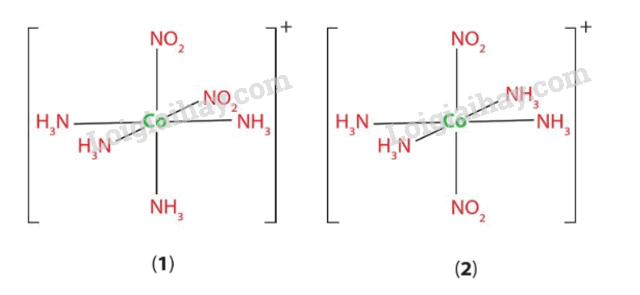
Chỉ ra dạng cis và dạng trans trong hai đồng phân dưới đây:

Dựa vào dạng hình học của phức chất.

Hình (1) là dạng trans; Hình (2) là dạng cis.
