Câu hỏi trang 38
Đầu thế kỉ XX, các kết quả nghiên cứu về cơ học lượng tử đã góp phần làm rõ hơn bản chất của liên kết hoá học trong các phân tử. Nhờ đó, bản chất liên kết trong phức chất cũng được làm rõ hơn bởi thuyết Liên kết hoá trị (VB, valence bond). Thuyết Liên kết hoá trị mô tả sự hình thành liên kết trong phức chất như thế nào? Các phức chất có dạng hình học xác định không? Phức chất có những loại đồng phân nào?

Mô tả sự hình thành liên kết trong phức chất trong thuyết Liên kết hóa trị. Nêu các dạng hình học và các loại đồng phân của phức chất.

- Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm. Kiểu lai hoá các orbital của nguyên tử trung tâm quyết định dạng hình học của phức chất.
- Các phức chất có dạng hình học xác định:
+ Phức chất loại [ML4] thường có dạng hình học tứ diện hoặc vuông phẳng.
+ Phức chất loại [ML6] thường có dạng bát diện.
- Phức chất có các loại đồng phân khác nhau, trong đó có một số loại cơ bản là đồng phân cis - trans, đồng phân ion hoá và đồng phân liên kết.
Câu hỏi trang 39 Tranh luận (TL)
Hãy cho biết số phối trí của nguyên tử trung tâm và dung lượng phối trí của phối tử trong phức chất được nêu ở các Ví dụ 1 và 2.

- Số liên kết s giữa nguyên tử trung tâm với các phối tử gọi là số phối trí.
- Dung lượng phối trí của một phối tử bằng số liên kết ở giữa phối tử đó với nguyên tử trung tâm khi hình thành phức chất.

- Ví dụ 1: Trong phức chất \({\left[ {{\rm{CoC}}{{\rm{l}}_4}} \right]^{2 - }}\)có 4 phối tử \({\rm{C}}{{\rm{l}}^ - }\), mỗi phối tử tạo một liên kết s với \({\rm{C}}{{\rm{o}}^{2 + }}\)nên số phối trí của nguyên tử trung tâm \({\rm{C}}{{\rm{o}}^{2 + }}\)trong phức chất này là 4, dung lượng phối trí của phối tử \({\rm{C}}{{\rm{l}}^ - }\)là 1.
- Ví dụ 2: Trong phức chất \({\left[ {{\rm{Zn(N}}{{\rm{H}}_3}{)_4}} \right]^{2 + }}\)có 4 phối tử \({\rm{N}}{{\rm{H}}_{\rm{3}}}\), mỗi phối tử tạo một liên kết cho nhận với \({\rm{Z}}{{\rm{n}}^{2 + }}\)nên số phối trí của nguyên tử trung tâm \({\rm{Z}}{{\rm{n}}^{2 + }}\)trong phức chất này là 4, dung lượng phối trí của phối tử \({\rm{N}}{{\rm{H}}_{\rm{3}}}\)là 1.
Câu hỏi trang 39 Luyện tập (LT)
Mô tả sự hình thành liên kết trong ion phức tứ diện \({[{\rm{Zn(OH}}{{\rm{)}}_{\rm{4}}}]^{2 - }}\)?

Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm. Kiểu lai hoá các orbital của nguyên tử trung tâm quyết định dạng hình học của phức chất.

Trong ion phức \({\left[ {{\rm{Zn(OH}}{)_4}} \right]^{2 - }}\)có 4 liên kết cho – nhận giữa 4 phối tử \({\rm{O}}{{\rm{H}}^ - }\)với nguyên tử trung tâm \({\rm{Z}}{{\rm{n}}^{2 + }}\) (có cấu hình electron [Ar]3d10). Mỗi liên kết cho – nhận được hình thành bởi 1 cặp electron chưa liên kết của phối tử \({\rm{O}}{{\rm{H}}^ - }\) và 1 orbital lai hoá sp3 trống của ion \({\rm{Z}}{{\rm{n}}^{2 + }}\).
Câu hỏi trang 40 Tranh luận (TL)
Hãy cho biết số phối trí của nguyên tử trung tâm và dung lượng phối trí của phối tử trong phức chất được nêu ở các Ví dụ 3 và 4.

- Số liên kết s giữa nguyên tử trung tâm với các phối tử gọi là số phối trí.
- Dung lượng phối trí của một phối tử bằng số liên kết ở giữa phối tử đó với nguyên tử trung tâm khi hình thành phức chất.

- Ví dụ 3: Trong phức chất \({\left[ {{\rm{Cr(N}}{{\rm{H}}_3}{)_6}} \right]^{3 + }}\)có 6 phối tử \({\rm{N}}{{\rm{H}}_{\rm{3}}}\), mỗi phối tử tạo một liên kết cho nhận với \({\rm{C}}{{\rm{r}}^{3 + }}\)nên số phối trí của nguyên tử trung tâm \({\rm{C}}{{\rm{r}}^{3 + }}\)trong phức chất này là 6, dung lượng phối trí của phối tử \({\rm{N}}{{\rm{H}}_{\rm{3}}}\)là 1.
- Ví dụ 4: Trong phức chất \({\left[ {{\rm{Co(}}{{\rm{H}}_{\rm{2}}}{\rm{O}}{)_6}} \right]^{3 + }}\)có 6 phối tử \({{\rm{H}}_{\rm{2}}}{\rm{O}}\), mỗi phối tử tạo một liên kết cho nhận với \({\rm{C}}{{\rm{o}}^{3 + }}\)nên số phối trí của nguyên tử trung tâm \({\rm{C}}{{\rm{o}}^{3 + }}\)trong phức chất này là 6, dung lượng phối trí của phối tử \({{\rm{H}}_{\rm{2}}}{\rm{O}}\)là 1.
Câu hỏi trang 40 Tranh luận (TL)
Mô tả sự hình thành liên kết trong ion phức \({\left[ {{\rm{Cu}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_6}} \right]^{2 + }}\).

Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm. Kiểu lai hoá các orbital của nguyên tử trung tâm quyết định dạng hình học của phức chất.

Trong ion phức \({\left[ {{\rm{Cu}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_6}} \right]^{2 + }}\) có 6 liên kết cho – nhận giữa 6 phối tử \({{\rm{H}}_{\rm{2}}}{\rm{O}}\)với nguyên tử trung tâm \({\rm{C}}{{\rm{u}}^{2 + }}\) (có cấu hình electron [Ar]3d9). Mỗi liên kết cho – nhận được hình thành bởi 1 cặp electron chưa liên kết của phối tử \({{\rm{H}}_{\rm{2}}}{\rm{O}}\) và 1 orbital lai hoá sp3d2 trống của ion \({\rm{C}}{{\rm{u}}^{2 + }}\).
Câu hỏi trang 41 Tranh luận (TL) 1
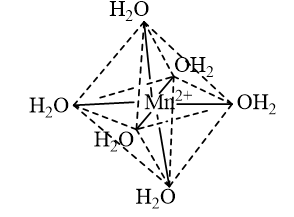
Biểu diễn dạng hình học của ion phức chất tứ diện \({\left[ {{\rm{FeC}}{{\rm{l}}_4}} \right]^ - }\) và ion phức chất bát diện \({\left[ {{\rm{Mn}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_{\rm{6}}}} \right]^{2 + }}\).

Các phức chất có dạng hình học xác định:
+ Phức chất loại [ML4] thường có dạng hình học tứ diện hoặc vuông phẳng.
+ Phức chất loại [ML6] thường có dạng bát diện.

- Dạng hình học của ion phức chất tứ diện \({\left[ {{\rm{FeC}}{{\rm{l}}_4}} \right]^ - }\):
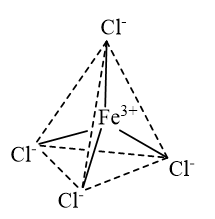
- Dạng hình học của ion phức chất bát diện \({\left[ {{\rm{Mn}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_{\rm{6}}}} \right]^{2 + }}\):
Câu hỏi trang 41 Luyện tập (LT)
Hãy dự đoán và biểu diễn dạng hình học của ion phức chất\({\left[ {{\rm{Co}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_6}} \right]^{2 + }}\).

Các phức chất có dạng hình học xác định:
+ Phức chất loại [ML4] thường có dạng hình học tứ diện hoặc vuông phẳng.
+ Phức chất loại [ML6] thường có dạng bát diện.

Advertisements (Quảng cáo)
Phức chất \({\left[ {{\rm{Co}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_6}} \right]^{2 + }}\)có dạng bát diện và được biểu như sau:
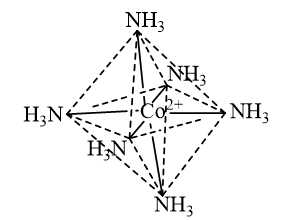
Câu hỏi trang 41 Tranh luận (TL) 2
Dựa vào Hình 7.6 và 7.7, hãy nêu cách phân biệt đồng phân cis- và đồng phân trans- của phức chất

Đồng phân cis – trans được tạo ra khi có sự phân bố khác nhau của các phối tử xung quanh nguyên tử trung tâm. Phức chất vuông phẳng và phức chất bát diện có thể có đồng phân cis - trans.

- Phức chất với hai phối tử giống nhau nằm cùng một phía đối với nguyên tử trung tâm được gọi là đồng phân cis-.
- Phức chất với hai phối tử giống nhau nằm khác phía đối với nguyên tử trung tâm được gọi là đồng phân trans-.
Câu hỏi trang 42 Luyện tập (LT)
Biểu diễn các đồng phân cis – trans của phức chất bát diện \(\left[ {{\rm{CrC}}{{\rm{l}}_{\rm{2}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{4}}}} \right]{\rm{Cl}}\)và phức chất vuông phẳng \(\left[ {{\rm{NiC}}{{\rm{l}}_{\rm{2}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{2}}}} \right]\).

Đồng phân cis – trans được tạo ra khi có sự phân bố khác nhau của các phối tử xung quanh nguyên tử trung tâm.

- Đồng phân cis – trans của phức chất bát diện \(\left[ {{\rm{CrC}}{{\rm{l}}_{\rm{2}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{4}}}} \right]{\rm{Cl}}\):
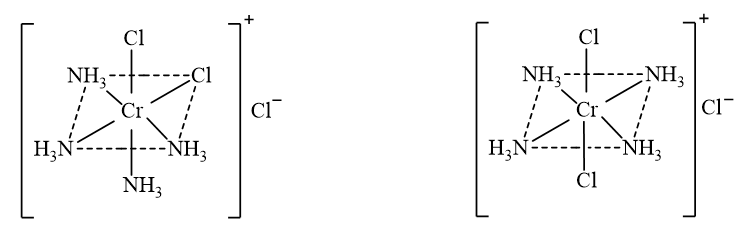
cis - \(\left[ {{\rm{CrC}}{{\rm{l}}_{\rm{2}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{4}}}} \right]{\rm{Cl}}\) trans - \(\left[ {{\rm{CrC}}{{\rm{l}}_{\rm{2}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{4}}}} \right]{\rm{Cl}}\)
- Đồng phân cis – trans của phức chất vuông phẳng \(\left[ {{\rm{NiC}}{{\rm{l}}_{\rm{2}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{2}}}} \right]\):

cis - \(\left[ {{\rm{NiC}}{{\rm{l}}_{\rm{2}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{2}}}} \right]\) trans - \(\left[ {{\rm{NiC}}{{\rm{l}}_{\rm{2}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{2}}}} \right]\)
Câu hỏi trang 42 Tranh luận (TL)
Viết công thức đồng phân ion hoá của phức chất \(\left[ {{\rm{CrBr}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{5}}}} \right]{\rm{S}}{{\rm{O}}_{\rm{4}}}\).

Đồng phân ion hóa thường được tạo ra do có sự hoán đổi phối tử anion trong cầu nội và anion ở cầu ngoại.

Đồng phân ion hoá của phức chất \(\left[ {{\rm{CrBr}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{5}}}} \right]{\rm{S}}{{\rm{O}}_{\rm{4}}}\) là \(\left[ {{\rm{Cr}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{5}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right]{\rm{Br}}\).
Mô tả sự hình thành liên kết, biểu diễn dạng hình học của các ion phức chất sau:
a) Phức chất bát diện \({\left[ {{\rm{Fe}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_{\rm{6}}}} \right]^{{\rm{3 + }}}}\).
b) Phức chất tứ diện \({\left[ {{\rm{CoB}}{{\rm{r}}_{\rm{4}}}{\rm{ }}} \right]^{{\rm{2 - }}}}\).

- Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm. Kiểu lai hoá các orbital của nguyên tử trung tâm quyết định dạng hình học của phức chất.
- Các phức chất có dạng hình học xác định:
+ Phức chất loại [ML4] thường có dạng hình học tứ diện hoặc vuông phẳng.
+ Phức chất loại [ML6] thường có dạng bát diện.

a) Trong ion phức \({\left[ {{\rm{Fe}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_{\rm{6}}}} \right]^{{\rm{3 + }}}}\)có 6 liên kết cho – nhận giữa 6 phối tử \({{\rm{H}}_{\rm{2}}}{\rm{O}}\)với nguyên tử trung tâm \({\rm{F}}{{\rm{e}}^{3 + }}\) (có cấu hình electron [Ar]3d5). Mỗi liên kết cho – nhận được hình thành bởi 1 cặp electron chưa liên kết của phối tử \({{\rm{H}}_{\rm{2}}}{\rm{O}}\) và 1 orbital lai hoá sp3d2 trống của ion \({\rm{F}}{{\rm{e}}^{3 + }}\).
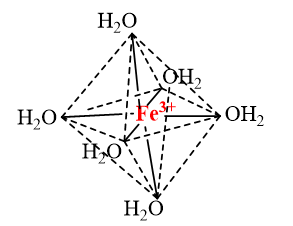
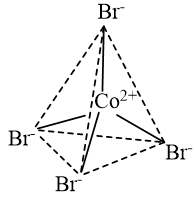
b) Trong ion phức \({\left[ {{\rm{CoB}}{{\rm{r}}_{\rm{4}}}{\rm{ }}} \right]^{{\rm{2 - }}}}\)có 4 liên kết cho – nhận giữa 4 phối tử \({\rm{B}}{{\rm{r}}^ - }\)với nguyên tử trung tâm \({\rm{C}}{{\rm{o}}^{2 + }}\) (có cấu hình electron [Ar]3d7). Mỗi liên kết cho – nhận được hình thành bởi 1 cặp electron chưa liên kết của phối tử \({\rm{B}}{{\rm{r}}^ - }\) và 1 orbital lai hoá sp3 trống của ion \({\rm{C}}{{\rm{o}}^{2 + }}\).
Xác định số phối trí của nguyên tử trung tâm trong các phức chất sau:
a) \({\rm{Na}}\left[ {{\rm{PtC}}{{\rm{l}}_{\rm{5}}}\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)} \right]\);
b) \(\left[ {{\rm{CrC}}{{\rm{l}}_{\rm{3}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{3}}}} \right]\).

Số liên kết s giữa nguyên tử trung tâm với các phối tử gọi là số phối trí.

a) Trong phức chất \({\rm{Na}}\left[ {{\rm{PtC}}{{\rm{l}}_{\rm{5}}}\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)} \right]\)có 5 phối tử \({\rm{C}}{{\rm{l}}^ - }\) và 1 phối tử \({\rm{N}}{{\rm{H}}_{\rm{3}}}\), mỗi phối tử tạo một liên kết s với \({\rm{P}}{{\rm{t}}^{4 + }}\)nên số phối trí của nguyên tử trung tâm \({\rm{P}}{{\rm{t}}^{4 + }}\)trong phức chất này là 6.
b) Trong phức chất \(\left[ {{\rm{CrC}}{{\rm{l}}_{\rm{3}}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{3}}}} \right]\)có 3 phối tử \({\rm{C}}{{\rm{l}}^ - }\) và 3 phối tử \({\rm{N}}{{\rm{H}}_{\rm{3}}}\), mỗi phối tử tạo một liên kết s với \({\rm{C}}{{\rm{r}}^{3 + }}\)nên số phối trí của nguyên tử trung tâm \({\rm{C}}{{\rm{r}}^{3 + }}\)trong phức chất này là 6.
Ion phức chất \({\left[ {{\rm{Cr}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_4}{\rm{B}}{{\rm{r}}_{\rm{2}}}} \right]^ + }\) có dạng hình học bát diện. Hãy biểu diễn các đồng phân cis- và trans- của phức chất.

Đồng phân cis – trans được tạo ra khi có sự phân bố khác nhau của các phối tử xung quanh nguyên tử trung tâm.


cis - \({\left[ {{\rm{Cr}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_4}{\rm{B}}{{\rm{r}}_{\rm{2}}}} \right]^ + }\) trans - \({\left[ {{\rm{Cr}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_4}{\rm{B}}{{\rm{r}}_{\rm{2}}}} \right]^ + }\)
