Câu hỏi/bài tập:
Hãy vẽ sơ đồ hình thành liên kết ion trong các phân tử sau, sử dụng các dấu chấm để biểu diễn các electron (tương tự hình 6.2 trang 37 SGK):
a) Lithium fluoride (LiF).
b) Calcium oxide (CaO).
c) Potassium oxide (K2O).

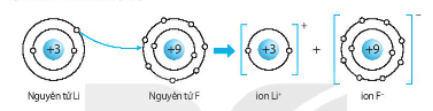
a) Lithium fluoride (LiF).
Nguyên tử kim loại Li có 1 electron lớp ngoài cùng, để đạt được 2 electron lớp ngoài cùng giống khí hiếm He gần nó thì nguyên tử Li nhường nguyên tử F 1 electron.
Nguyên tử F có 7 electron lớp ngoài cùng, cần nhận thêm 1 electron để đạt được 8 electron lớp ngoài cùng giống Neon.
⇨ 1 nguyên tử Li liên kết ion với 1 nguyên tử F.
Advertisements (Quảng cáo)
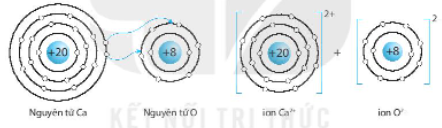
b) Calcium oxide (CaO).
Nguyên tử kim loại Ca có 2 electron lớp ngoài cùng, để đạt được 8 electron lớp ngoài cùng giống khí hiếm Ar gần nó thì nguyên tử Ca nhường 2 electron.
Nguyên tử O có 6 electron lớp ngoài cùng, cần nhận thêm 2 electron để đạt được 8 electron lớp ngoài cùng giống Neon.
⇨ 1 nguyên tử Ca liên kết ion với 1 nguyên tử O.
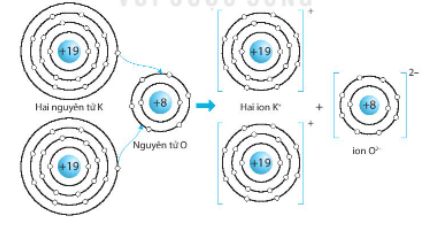
c) Potassium oxide (K2O).
Nguyên tử kim loại K có 1 electron lớp ngoài cùng, để đạt được 8 electron lớp ngoài cùng giống khí hiếm Ar gần nó thì nguyên tử K nhường 1 electron.
Nguyên tử O có 6 electron lớp ngoài cùng, cần nhận thêm 2 electron để đạt được 8 electron lớp ngoài cùng giống Neon.
⇨ 2 nguyên tử K liên kết ion với 1 nguyên tử O.