Câu hỏi/bài tập:
Phát biểu nào sau đây không đúng?
A. Nguyên tử có Z = 11 có bán kính nhỏ hơn nguyên tử có Z = 19.
B. Nguyên tử có Z = 12 có bán kính lớn hơn nguyên tử có Z = 10.
C. Nguyên tử có Z = 11 có bán kính nhỏ hơn nguyên tử có Z = 13.
D. Các nguyên tố kim loại kiềm có bán kính nguyên tử lớn nhất trong chu kì.

- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng

- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
Advertisements (Quảng cáo)
+ Nguyên tố có Z = 10 => Cấu hình electron là: 1s22s22p6
=> Nguyên tố này thuộc chu kì 2, nhóm VIIIA
+ Nguyên tố có Z = 11 => Cấu hình electron là: 1s22s22p63s1
=> Nguyên tố này thuộc chu kì 3, nhóm IA
+ Nguyên tố có Z = 12 => Cấu hình electron là: 1s22s22p63s2
=> Nguyên tố này thuộc chu kì 3, nhóm IIA
+ Nguyên tố có Z = 13 => Cấu hình electron là: 1s22s22p63s23p1
=> Nguyên tố này thuộc chu kì 3, nhóm IIIA
+ Nguyên tố có Z = 19 => Cấu hình electron là: 1s22s22p63s23p64s1
=> Nguyên tố này thuộc chu kì 4, nhóm IA
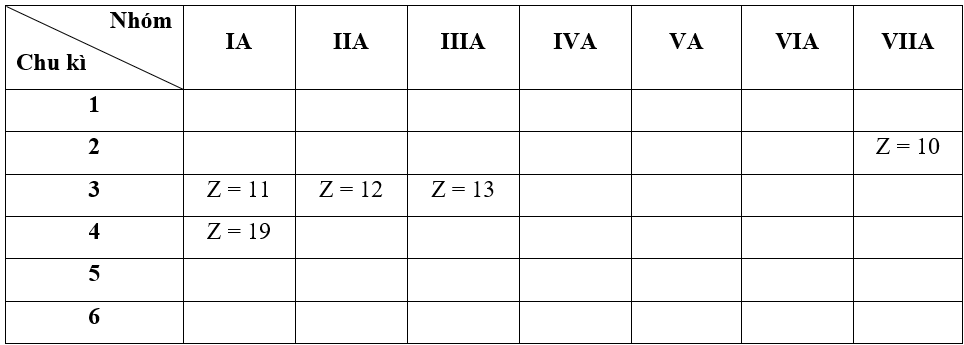
- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử:
+ Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: Z = 11 < Z = 19
+ Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: Z = 13 < Z = 11
=> Đáp án: C
