Câu hỏi/bài tập:
Cho enthalpy tạo thành tiêu chuẩn của các chất trong bảng sau.
|
Chất |
C6H6 (l) |
C2H5OH (l) |
CH3COOH (l) |
CO2 (g) |
H2O (g) |
|
\({\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)(kJ/mol) |
49,00 |
-277,63 |
-487,00 |
-393,50 |
-241,82 |
a) Viết phương trình đốt chảy hoàn toàn C6H6, C2H5OH và CH3COOH với hệ số nguyên tối giản.
b) Chất nào trong các chất trên có biến thiên enthalpy của phản ứng lớn hơn (\({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)âm hơn).
Advertisements (Quảng cáo)
c) Từ kết quả tính toán hãy so sánh biến thiên enthalpy của phản ứng khi đốt cháy cùng khối lượng C6H6, C2H5OH và CH3COOH

a) Sản phẩm của các phương trình cháy là CO2 và H2O.
b) Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo enthalpy tạo thành:
\[{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(sp)}} - \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(tg) }}\]
Nhiệt tạo thành của đơn chất bằng 0.
c) Lấy khối lượng của các chất trên bằng nhau rồi tính mol và biến thiên enthalpy của phản ứng.

a) Phương trình đốt chảy hoàn toàn của các chất với hệ số nguyên tối giản:
C6H6 (l) C2H5OH (l) CH3COOH (l) CO2 (g) H2O (g)
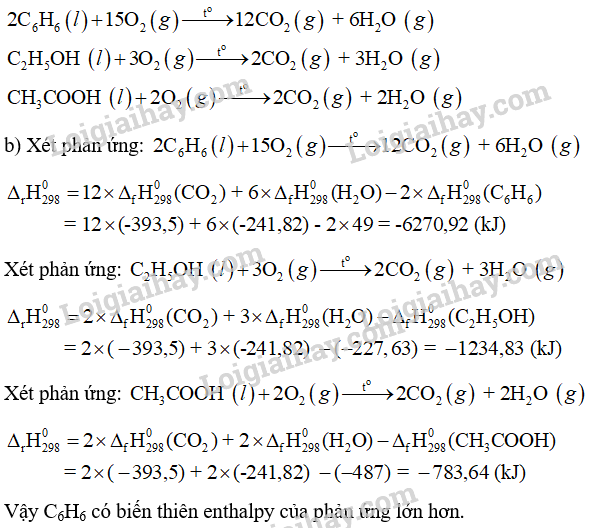
c) Xét khối lượng của mỗi chất là 89,7 g.
\({{\rm{n}}_{{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{6}}}}} = \frac{{89,70}}{{78}} = 1,15{\rm{ (mol)}} \Rightarrow {\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = {\rm{ - 6270,92}} \times \frac{{1,15}}{2} \approx - 3605,78{\rm{ (kJ)}}\)
\({{\rm{n}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = \frac{{89,7}}{{46}} = 1,95{\rm{ (mol)}} \Rightarrow {\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - {\rm{1234,83}} \times 1,95 \approx - 2407,92{\rm{ (kJ)}}\)
\({{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}} = \frac{{89,7}}{{60}} = 1,495{\rm{ (mol)}} \Rightarrow {\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - {\rm{783,64}} \times 1,495 \approx - 1171,54{\rm{ (kJ)}}\)
Vậy khi đốt cháy cùng khối lượng thì biến thiên enthalpy của phản ứng đốt cháy giảm dần theo thứ tự: C6H6, C2H5OH, CH3COOH.
