3.1
Ở trạng thái tự nhiên, nitrogen
A. tồn tại ở dạng đơn chất và hợp chất.
B. chỉ tồn tại ở dạng đơn chất.
C. chỉ tồn tại ở dạng hợp chất.
D. tự do chiếm khoảng 20% thể tích không khí.

Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
Ở dạng đơn chất, nitrogen chiếm khoảng 78% thể tích của không khí. Nitrogen trong tự nhiên là hỗn hợp của hai đồng vị: \[{}_{\rm{7}}^{{\rm{14}}}{\rm{N}}\] (99,63%) và \[{}_{\rm{7}}^{{\rm{15}}}{\rm{N}}\] (0,37%).
Ở dạng hợp chất, nitrogen có nhiều trong khoáng vật sodium nitrate (NaNO3) với tên gọi là diêm tiêu natri. Nitrogen còn có trong thành phần của protein, nucleic acid, ... và nhiều hợp chất hữu cơ khác

Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
→ Chọn A.
3.2
Cấu hình electron nguyên tử của nitrogen là
A. 1s22s22p1. B. 1s22s22p5.
C. 1s22s22p4. D. 1s22s22p3.

Nitrogen là nguyên tố nằm ở ô số 7, nhóm VA trong bảng tuần hoàn.

N (Z = 7): 1s22s22p3
→ Chọn D.
3.3
Tính chất nào sau đây của nitrogen không đúng?
A. Ở điều kiện thường, nitrogen là chất khí.
B. Nitrogen tan rất ít trong nước.
C. Nitrogen không duy trì sự cháy và sự hô hấp.
D. Nitrogen nặng hơn không khí.

Tính chất vật lý của nitrogen: Ở điều kiện thường nitrogen là chất khí không màu, không mùi, không vị, nhẹ hơn không khí, hóa lỏng ở -196 oC, hóa rắn ở -210 oC, rất ít tan trong nước. Nitrogen không có khả năng duy trì sự cháy.

Ta có: \[{{\rm{d}}_{{\raise0.7ex\hbox{${{{\rm{N}}_{\rm{2}}}}$} \!\mathord{\left/
{\vphantom {{{{\rm{N}}_{\rm{2}}}} {{\rm{kk}}}}}\right.\kern-\nulldelimiterspace}
\!\lower0.7ex\hbox{${{\rm{kk}}}$}}}}{\rm{ = }}\frac{{{\rm{28}}}}{{{\rm{29}}}}{\rm{
→ Chọn D.
3.4
Nitrogen trong không khí có vai trò nào sau đây?
A. Cung cấp đạm tự nhiên cho cây trồng.
B. Hình thành sấm sét.
C. Tham gia quá trình quang hợp của cây.
D. Tham gia hình thành mây.

Nitrogen là khí có hàm lượng lớn nhất trong không khí, có vai trò cung cấp đạm tự nhiên cho cây trồng.

Trong không khí, nitrogen cung cấp đạm tự nhiên cho cây trồng.
→ Chọn A.
3.5
a) Tại sao nitrogen là phi kim mạnh lại tồn tại được trong tự nhiên dưới dạng tự do?
b) Tại sao nitrogen phản ứng được với nhiều kim loại, nhưng trong vỏ Trái Đất không gặp một nitride (N3-) kim loại nào cả?

a) Trong phân tử nitrogen có liên kết ba bền vững với năng lượng liên kết lớn (945 kJ/mol).
b) Các hợp chất nitride kim loại dễ bị thủy phân thành base kiềm và ammonia.

a) Nitrogen là phi kim mạnh, nhưng đơn chất nitrogen hoạt động hoá học kém ở nhiệt độ thường, tồn tại được trong tự nhiên (khí quyển) vì phân tử N2 có liên kết ba (N≡N) rất bền, không thể phân huỷ thành nguyên tử khi ở nhiệt độ thấp hoặc không có xúc tác.
b) N2 phản ứng với nhiều kim loại (với Li ở nhiệt độ thường và với Ca, Mg ở nhiệt độ cao) tạo ra các nitride kim loại (Li3N, Ca3N2, Mg3N2...). Thời kì đầu hình thành, Trái Đất rất nóng, tạo điều kiện cho nitrogen có thể tạo nitride với kim loại mạnh. Nhưng ở nhiệt độ này hydrogen và oxygen cũng đã hoá hợp với nhau tạo thành nước. Khi có mặt nước, các nitride kim loại đều bị thuỷ phân thànhbase kiềm và ammonia.
Ví dụ:Ca3N2 +6H2O → 2NH3 + 3Ca(OH)2
Advertisements (Quảng cáo)
Vì lý do trên nên vỏ Trái Đất không tồn tại các hợp chất nitride kim loại.
3.6
Viết phản ứng chứng minh nitrogen hoạt động hoá học ở nhiệt độ cao.

Ở nhiệt độ cao, nitrogen có thể tác dụng được với nhiều chất.

\[{\rm{3Ca + }}{{\rm{N}}_{\rm{2}}} \to {\rm{C}}{{\rm{a}}_{\rm{3}}}{{\rm{N}}_{\rm{2}}}\].
\[{{\rm{N}}_{\rm{2}}}{\rm{ + }}{{\rm{O}}_{\rm{2}}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ 2NO }}\]
3.7
Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.

Tổng quát, nếu có phản ứng thuận nghịch sau:aA+bB \[ \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \] cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.

\[{\rm{ }}{{\rm{N}}_{\rm{2}}}{\rm{(g) + 3}}{{\rm{H}}_2}{\rm{(g)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ 2N}}{{\rm{H}}_3}{\rm{(g)}}\]
Ban đầu (mol): 0,5 1,5 0
Phản ứng (mol): 0,1 ← 0,3 ← 0,2
Cân bằng (mol): 0,4 1,2 0,2
\[ \Rightarrow {\rm{[}}{{\rm{N}}_{\rm{2}}}{\rm{] = }}\frac{{{\rm{0,4}}}}{{0,5}}{\rm{ = 0,8 (M); [}}{{\rm{H}}_2}{\rm{] = }}\frac{{{\rm{1,2}}}}{{0,5}}{\rm{ = 2,4 (M); [N}}{{\rm{H}}_3}{\rm{] = }}\frac{{{\rm{0,2}}}}{{0,5}}{\rm{ = 0,4 (M)}}\]
\[ \Rightarrow {{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[N}}{{\rm{H}}_3}{\rm{]}}}^{\rm{2}}}}}{{{\rm{[}}{{\rm{N}}_{\rm{2}}}{\rm{][}}{{\rm{H}}_{\rm{2}}}{{\rm{]}}^3}}} = \frac{{0,{4^2}}}{{0,8 \times 2,{4^3}}} \approx 0,014\]
3.8
Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
– Năng lượng liên kết ba N≡N là 941 kJ/mol.
– Năng lượng liên kết ba P≡P là 490 kJ/mol.
– Năng lượng liên kết đơn N-N là 160 kJ/mol.
– Năng lượng liên kết đơn P-P là 209 kJ/mol.

Tính năng lượng liên kết trong phân tử P4,P2, N4, N2.
So sánh năng lượng giữa các phân tử P4 và P2, N4 và N2.
Phân tử càng bền, năng lượng liên kết trong phân tử (hay năng lượng giải phóng khi tạo thành phân tử) càng lớn.

+ Xét 4 nguyên tử P tạo thành:
- Phân tử P4 gồm 4 nguyên tử P liên kết với nhau bằng 6 liên kết đơn P-P.
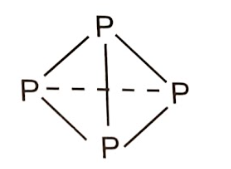
Năng lượng được giải phóng khi tạo một phân tử P4: 6 × 209 = 1254 (kJ).
- Phân tử P2 gồm 2 phân tử P≡P. Năng lượng được giải phóng khi tạo hai phân tử P2: 2 × 490 = 980 (kJ).
→ Phân tử P4 bền hơn P2 nên ở điều kiện thường, phosphorus trắng tồn tại ở dạng phân tử P4.
+ Xét 4 nguyên tử N tạo thành:
- Phân tử N4 gồm 4 nguyên tử N liên kết với nhau bằng 6 liên kết đơn N-N. Năng lượng được giải phóng khi tạo một phân tử N4: 6×160 = 960 (kJ).
- Phân tử N2 gồm 2 phân tử N≡N. Năng lượng được giải phóng khi tạo hai phân tử N2: 2 × 941 = 1882 (kJ).
=> Phân tử N2 bền hơn N4 ở điều kiện thường.
3.9
Xác định cụm từ phù hợp trong các ô từ (1) đến (7) để hoàn thành chu trình của nitrogen trong tự nhiên.
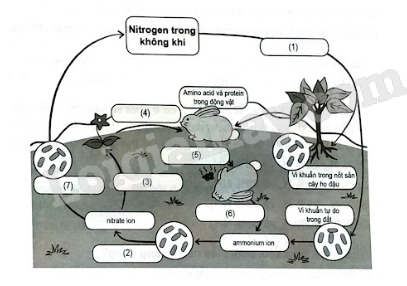

Chu trình Nitrogen là một quá trình mà theo đó Nitrogen bị biến đổi qua lại giữa các dạng hợp chất hóa học của nó. Việc biến đổi này có thể được tiến hành bởi cả hai quá trình sinh học và phi sinh học.
Thực vật đồng hoá nitrogen bằng cách hấp thụ chúng qua rễ cây chủ yếu ở dạng muối nitrate và muối ammonium, chuyển hoá chúng thành protein thực vật. Động vật đồng hoá protein thực vật, tạo ra protein động vật. Các chất hữu cơ do động vật bài tiết ra (phân, nước tiểu, ...) cũng như xác động vật bị phân huỷ chuyển thành các hợp chất hữu cơ chứa nitrogen. Nhờ những loại vi khuẩn khác nhau có trong đất, một phần các hợp chất này chuyển hoá thành ammonia, sau đó chuyển hoá thành muối nitrate, phần còn lại bị thoát ra ở dạng nitrogen bay vào khí quyển. Khi đốt cháy các chất hữu cơ (than gỗ, than đá, than bùn, ...), cũng tạo thành nitrogen tự do.

(1) Quá trình cố định đạm.
(2) Quá trình nitrate hóa bởi vi khuẩn.
(3) Quá trình hấp thu đạm của rễ cây.
(4) Động vật sử dụng thức ăn là thực vật.
(5) Động vật chết.
(6) Quá trình phân hủy xác động vật.
(7) Quá trình khử nitrogen.
