Bài tập 1
Điều nào sau đây đúng về tính chất hoá học của N2?
A. N2 chỉ có tính khử.
B. N2 chỉ có tính oxi hoá.
C. N2 vừa có tính khử, vừa có tính oxi hoá.
D. N2 có tính acid.

- Các số oxi hóa có thể có của nguyên tố nitrogen trong các hợp chất: -3, 0, +1, +2, +3, +5.
- Trong phản ứng oxi hóa khử:
+ Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng.
+ Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng.

Ta có, số oxi hóa của N2 là 0. Đây là số oxi hóa trung gian của N.
→ N2 vừa có tính khử, vừa có tính oxi hoá.
→ Chọn C.
Bài tập 2
Điều nào sau đây đúng về tính chất hoá học của NH3?
A. NH3 chỉ có tính khử.
B. NH3 chỉ có tính oxi hoá.
C. NH3 vừa có tính khử, vừa có tính oxi hoá.
D. NH3 có tính acid.

- Các số oxi hóa có thể có của nguyên tố nitrogen trong các hợp chất: -3, 0, +1, +2, +3, +5.
- Trong phản ứng oxi hóa khử:
+ Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng.
+ Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng.

Ta có, số oxi hóa của NH3 là -3. Đây là số oxi hóa thấp nhất của N.
→ NH3 chỉ có tính khử.
→ Chọn A.
Bài tập 3
Điều nào sau đây không đúng về tính chất hoá học của dung dịch HNO3?
A. Dung dịch HNO3 có tính khử mạnh.
B. Dung dịch HNO3 có tính oxi hoá mạnh.
C. Dung dịch HNO3 đặc, nguội không phản ứng với Fe.
D. Dung dịch HNO3 có tính acid.

Nitric acid là một acid mạnh, tính oxi hóa mạnh.
Nitric acid đặc nguội không phản ứng với Fe.

Dung dịch HNO3 có không tính khử.
→ Chọn A.
Bài tập 4
Phát biểu nào diễn tả đúng tính chất hoá học của SO2?
A. SO2 chỉ có tính khử.
B. SO2 chỉ có tính oxi hoá.
C. SO2 vừa có tính khử, vừa có tính oxi hoá.
D. SO2 không có tính khử và không có tính oxi hoá.

Số oxi hóa của S: -2; 0; +2; +4; +6
- Trong phản ứng oxi hóa khử:
+ Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng.
+ Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng.

Ta có, số oxi hóa của SO2 là +4. Đây là số oxi hóa trung gian của S.
→ . SO2 vừa có tính khử, vừa có tính oxi hoá.
→ Chọn C.
Bài tập 5
Điều nào sau đây đúng về tính chất hoá học của dung dịch H2SO4 đặc?
A. Dung dịch H2SO4 đặc có tính khử mạnh.
Advertisements (Quảng cáo)
B. Dung dịch H2SO4 đặc có tính oxi hoá mạnh.
C. Dung dịch H2SO4 đặc vừa có tính khử, vừa có tính oxi hoá.
D. Dung dịch H2SO4 đặc không có tính khử, không có tính oxi hoá.

Dung dịch sulfuric acid đặc có tính acid mạnh, tính oxi hoá mạnh và tính háo nước.

Các số oxi hóa có thể có của sulfur: -2; 0; +2; +4; +6.
Vì +6 là số oxi hóa lớn nhất của sulfur, do đó trong các phản ứng oxi hóa khử, số oxi hóa của sulfur chỉ có thể giảm về +4 (hoặc +2; 0; -2). Vậy trong phản ứng oxi hóa khử H2SO4 đặc không có khả năng thể hiện tính khử, mà chỉ thể hiện tính oxi hóa.
→ Chọn B.
Bài tập 6
Hãy xếp các nội dung sau cho hợp lý trong quá trình hình thànhsắp hiện tượng phú dưỡng:
(A) Sự phân huỷ xác động thực vật bởi vi khuẩn sử dụng nhiều oxygen trong nước gây nên tình trạng thiếu oxygen nghiêm trọng, làm chết cả hệ sinh thái.
(B) Ánh sáng mặt trời bị cản trở làm ảnh hưởng đến quá trình quang hợp. gây thiếu oxygen làm cho thực vật và động vật chết.
(C) Chất dinh dưỡng giúp thực vật và tảo sống trong nước phát triển ồ ạt.
(D) Phân bón và chất dinh dưỡng bị rửa trôi xuống sông, ao, hồ, ...

Phú dưỡng là hiện tượng ao, hồ dư quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphorus).

Quá trình hình thànhsắp hiện tượng phú dưỡng: (D), (C), (B), (A).
Bài tập 7
Nguyên tắc vận tải bằng đường xe lửa đối với sulfuric acid đặc chứatrong các toa thùng yêu cầu nghiêm ngặt rằng phải đóng kín ngay tức khắc vòi thoát sau khi tháo acid ra khỏi toa thùng. Hãy giải thích điều này.

Người ta sử dụng các thùng thép (thành phần chính là Fe) để chứa sulfuric acid đặc. Sulfuric acid đặc, nguội không phản ứng với sắt, nhưng sulfuric acid loãng tác dụng với sắt. sulfuric acid đặc có tính háu nước.

Sulfuric acid đặc ở nhiệt độ thường không tác dụng với Fe (do Fe bị thụ động hoá bởi H2SO4 đặc nguội) nên có thể chuyên chở được trong các toa thùng bằng thép. Khi vòi thoát không được đóng kín ngay, sulfuric acid đặc hấp thụ hơi nước trong không khí rất mạnh và trở thành acid loãng sẽ ăn mòn thành toa thùng rất nhanh.
Bài tập 8
Sơ đồ quy trình dưới đây mô tả các bước trong quá trình sản xuất một số loại phân bón. Hãy xác định các chất (A), (X), (Y), (Z), (Q). Viết các phản ứng hoá học xảy ra.
Không khí → (A)
Methane → (X)
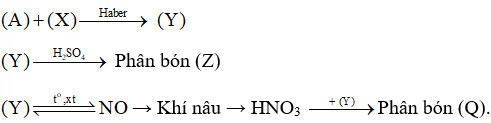

(A) là N2.
(X) là H2.
(Y) là NH3.
(Z) là (NH4)2SO4.
(Q) NH4NO3.

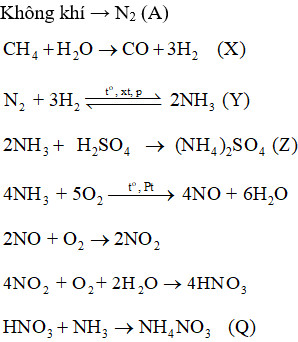
Bài tập 9
Đặt hai cốc (A), (B) có khối lượng bằng nhau lên 2 đĩa cân, cân ở vị trí thăng bằng. Cho 120 gam hỗn hợp potassium hydrogencarbonate và sodium hydrogencarbonate vào cốc (A); 85 gam silver nitrate vào cốc (B). Thêm từ từ 100 gam dung dịch sulfuric acid 19,6% vào cốc (A); 100 gam dung dịch hydrochloric acid 36,5% vào cốc (B). Sau thí nghiệm, cân có ở vị trí thăng bằng không? Nếu cân không ở vị trí thăng bằng thì cần thêm bao nhiêu gam dung dịch hydrochloric acid 36,5% vào cốc nào để cân trở lại vị trí thăng bằng? Giả thiết khí CO2 không tan trong nước, bỏ qua quá trình bay hơi của nước và hydrogen chloride.

- Tính khối lượng của cốc (A) và cốc (B) sau phản ứng.
- Khối lượng dung dịch hydrochloric acid 36,5% vào cốc để hai cốc cân bằng là khối lượng chênh lệch của hai cốc sau phản ứng.
- Lưu ý:
+ Khối lượng hai cốc sau phản ứng bằng tổng khối lượng của các chất bỏ vào trừ đi khối lượng các chất bay ra.
+ Chú ý, nếu cốc (A) cần cho thêm HCl thì phải tính lượng CO2 bay ra sau khi dư phản ứng với H+.

- Xét cốc (A): Đặt công thức chung của KHCO3 và NaHCO3 là RHCO3.
Ta có:
\[\begin{array}{l}{{\rm{n}}_{{\rm{RHC}}{{\rm{O}}_{\rm{3}}}(1)}} = {{\rm{n}}_{{\rm{NaHC}}{{\rm{O}}_{\rm{3}}}}} = \frac{{120}}{{84}} \approx 1,4{\rm{ (mol)}}\\{{\rm{n}}_{{\rm{RHC}}{{\rm{O}}_{\rm{3}}}{\rm{(2)}}}} = {{\rm{n}}_{{\rm{KHC}}{{\rm{O}}_{\rm{3}}}}} = \frac{{120}}{{100}} = 1,2{\rm{ (mol)}}\end{array}\]
Đặt số mol của RHCO3 là x (1,2
\[{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} = 100 \times \frac{{19,6\% }}{{100\% }} = 19,6{\rm{ }}({\rm{g}}) \Rightarrow {{\rm{m}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} = \frac{{19,6}}{{98}} = 0,2{\rm{ (mol)}}\]
Ta có: 2RHCO3 + H2SO4 → R2SO4 + 2H2O + 2CO2
Vì \[\frac{{{{\rm{n}}_{{\rm{RHC}}{{\rm{O}}_{\rm{3}}}{\rm{(2)}}}}}}{2} > \frac{{{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}}}}{1}\left( {\frac{{1,2}}{2} > \frac{{0,2}}{1}} \right)\] nên RHCO3 dư, H2SO4 hết.
\[\begin{array}{l} \Rightarrow {{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}} = \frac{1}{2}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} = \frac{1}{2} \times 0,4 = 0,2{\rm{ (mol)}}\\ \Rightarrow {{\rm{m}}_{{\rm{(A)}}}} = {{\rm{m}}_{{\rm{RHC}}{{\rm{O}}_{\rm{3}}}}} + {{\rm{m}}_{{\rm{dd}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} - {{\rm{m}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}} = 120 + 100 - 0,2 \times 44 = 211,2{\rm{ (g)}}\end{array}\]
- Xét cốc (B): AgNO3 + HCl → AgCl + HNO3
Nước và hydrogen chloride không bay hơi \[ \Rightarrow {{\rm{m}}_{{\rm{(B)}}}} = {{\rm{m}}_{{\rm{AgN}}{{\rm{O}}_{\rm{3}}}}} + {{\rm{m}}_{{\rm{ddHCl}}}}{\rm{ = 85 + 100 = 185 (g)}}\]
Để cân bằng, ta cần thêm dung dịch hydrochloric acid 36,5% vào cốc (B).
Khối lượng dung dịch hydrochloric acid 36,5% cho vào cốc (B): \[{{\rm{m}}_{{\rm{ddHCl}}}} = {{\rm{m}}_{{\rm{(A)}}}} - {{\rm{m}}_{{\rm{(B)}}}}{\rm{ = 211,2}} - {\rm{185 = 26,2 (g)}}\]
