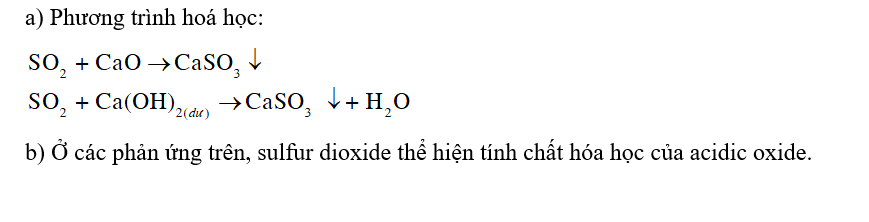Câu hỏi trang 39 Mở đầu
Việc lạm dụng sulfur để bảo quản dược liệu, thực phẩm khô,… có thể gây hại đến sức khỏe. Vì sao?

Sulfur (lưu huỳnh) nằm ở ô thứ 16, nhóm VIA trong bảng tuần hoàn.
Sulfur dioxide là một khí độc, gây hại đến sức khỏe con người.

Người ta sử dụng sulfur bảo quản dược liệu, thực phẩm khô,… bằng cách đốt cháy lưu huỳnh. Khi đốt sulfur sinh ra khí sulfur dioxdie. Đây là một khí độc, khi tiếp xúc với sulfur dioxdie ở một nồng độ nhất định, cơ thể cảm thấy khó thở, gây ra bệnh viêm đường hô hấp, đau mắt,… Tiếp xúc với SO2 nồng độ cao có thể làm chết người do ngưng hô hấp.
Câu hỏi trang 40 Câu hỏi
Trong tự nhiên, nguyên tố sulfur tồn tại ở dạng hợp chất dễ tan hay khó tan trong nước?

Đa số các muối sulfur không tan trong nước.

Phần lớn sulfur tồn tại ở dạng hợp chất trong thành phần của các khoáng vật, như pyrite (thành phần chính là FeS2), sphalerite (thành phần chính là ZnS), thạch cao (thành phần chính là CaSO4), barite (thành phần chính là BaSO4),... Ngoài ra, sulfur còn có trong thành phần của một số protein động vật, thực vật.
Các hợp chất trên đều là các hợp chất khó tan trong nước.
Câu hỏi trang 40 TN1
Thí nghiệm 1. Tính oxi hoá của sulfur
Chuẩn bị: Bột sulfur, bột sắt, giấy lọc, ống nghiệm chịu nhiệt, đũa thuỷ tinh, đèn cồn, giá thí nghiệm.
Tiến hành: Trộn đều hỗn hợp gồm khoảng 1 gam bột sắt và 0,6 gam bột sulfur trên mảnh giấy lọc. Cho hỗn hợp vào ống nghiệm chịu nhiệt, đặt ống nghiệm lên giá thí nghiệm. Đun nóng ống nghiệm trên ngọn lửa đèn cồn cho đến khi hỗn hợp “chảy” và hoá đen.
Yêu cầu: Viết phương trình hoá học của phản ứng đã diễn ra và cho biết vai trò của các chất trong phản ứng.

Sulfur oxi hóa được nhiều kim loại (trừ Pt, Ag, Au) ở nhiệt độ cao tạo muối sulfide.
Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.

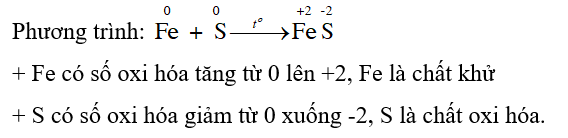
Câu hỏi trang 40 TN2
Thí nghiệm 2. Tính khử của sulfur
Chuẩn bị: Bột sulfur, giấy quỳ tím, muỗng đốt hoá chất (đã xuyên qua nút cao su), bình tam giác (loại nhỏ) chứa nước và khí oxygen.
Tiến hành: Dùng muỗng đốt hóa chất (đã được xuyên qua nút cao su) lấy một ít bột sulfur (khoảng 1/2 muỗng). Đeo khẩu trang. Đốt muỗng chứa sulfur trên ngọn lửa đèn cồn. Khi sulfur cháy thì đưa nhanh muỗng đốt vào bình tam giác chứa sẵn khí oxygen và một ít nước. Đậy kín bình bằng cách di chuyển nhanh nút cao su trên muỗng vào miệng bình. Khi ngọn lửa trong bình đã tắt thì lắc nhẹ bình rồi để yên khoảng 1 phút. Dùng giấy quỳ tím thử pH của dung dịch trong bình tam giác.
Yêu cầu: Viết phương trình hoá học của các phản ứng xảy ra trong quá trình thí nghiệm. Giải thích các hiện tượng quan sát được.

Acid làm quỳ tím hóa đỏ.

- Khi đốt lưu huỳnh trong không khí, lưu huỳnh cháy cho ngọn lửa nhỏ màu xanh nhạt, sau đó cho lưu huỳnh cháy trong khí oxygen, cho ngọn lửa lớn hơn màu sáng xanh.
Giải thích: lưu huỳnh cháy mạnh hơn trong khí oxygen tạo sulfur dioxide.
S + O2 → SO2
- Dùng giấy quỳ tím vào dung dịch trong bình tam giác, quỳ tím hóa đỏ.
Giải thích: Khí SO2 là acidic oxide khi tan trong nước tạo ra acid H2SO3 làm quỳ tím hóa đỏ, dung dịch trong bình tam giác có môi trường acid
SO2 + H2O → H2SO3
Câu hỏi trang 40 Câu hỏi 1
Sulfur dioxide thuộc loại oxide acid. Hãy cho biết sulfur dioxide có phản ứng được với calcium hydroxide, calcium oxide không.Viết phương trình hoá học của phản ứng xảy ra (nếu có).

Oxide acid phản ứng với nước tạo môi trường aicd, phản ứng với base oxide hoặc base tạo thành muối.

- Sulfur dioxide phản ứng với calcium hydroxide (base) và calcium oxide (base oxide).
- Phương trình:
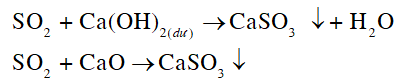
Câu hỏi trang 40 Câu hỏi 2
Hãy đề nghị công thức Lewis của SO2.

Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng. Các nguyên tử liên kết với nhau theo xu hướng chung là tạo ra lớp electron ngoài cùng như của khí hiếm gần nhất để mỗi nguyên tử đó trở nên bền vững hơn.

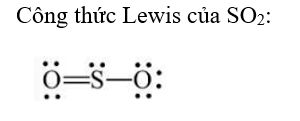
Câu hỏi trang 42 Câu hỏi 1
Nguyên tử sulfur thể hiện nhiều số oxi hoá khác nhau trong các hợp chất, như -2, +4, +6. Hãy giải thích vì sao SO2 có cả tính khử và tính oxi hoá.

Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.
Advertisements (Quảng cáo)

Số oxi hóa của S trong SO2 là +4. Đây là số oxi hóa trung gian của S.
Do đó trong các phản ứng oxi hóa khử:
+ Khi SO2 phản ứng với các chất oxi hóa, SO2 thể hiện tính khử tạo ra sản phẩm có số oxi hóa của sulfur là +6.
+ Khi SO2 phản ứng với các chất khử, SO2 thể hiện tính oxi hóa tạo ra sản phẩm có số oxi hóa của sulfur là 0 (sulfur đơn chất) hoặc -2.
Câu hỏi trang 42 Câu hỏi 2


Phản ứng đốt cháy quặng tạo ra khí SO2.

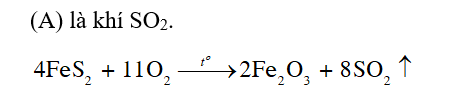
Câu hỏi trang 42 Câu hỏi 3
Hãy giải thích cơ sở hóa học của một số biện pháp giảm thải lượng sulfur dioxide vào không khí.

Các cơ sở hóa học của các biện pháp giảm thải lượng khí thường dùng: giảm nguồn khí thải phát sinh, xử lý khí thải trước khi xả thải,…

Một số biện pháp giảm thải lượng sulfur dioxide vào không khí:
• Thay thế dần các nhiên liệu hoá thạch bằng nhiên liệu thân thiện môi trường như ethanol, hydrogen,... kết hợp với khai thác các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió.
→ Cơ sở: Giảm nguồn phát thải khí SO2 bằng cách sử dụng nhiên liệu, năng lượng xanh.
• Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp, như than hoạt tính, hấp phụ khí sulfur dioxide, trước khi thải khí ra môi trường.
→ Cơ sở: Xử lý khí thải độc hại trước khi xả thải ra môi trường. Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm.
SO2 + C → S↓ + CO2
• Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hoá chất như vôi sống (thành phần chính là CaO), vôi tôi (thành phần chính là Ca(OH)2) hoặc đá vôi nghiền (thành phần chính là CaCO3).
→ Cơ sở: Xử lý khí thải độc hại trước khi xả thải ra môi trường. Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm
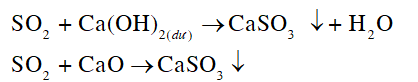
SO2 + CaCO3 → CaSO4↓
Ch trang 43 Câu hỏi
Vì sao nói hydrogen cũng như ethanol là nhiên liệu thân thiện với môi trường (nhiên liệu xanh)?

Phản ứng đốt cháy quặng tạo ra khí SO2.

- Nhiên liệu hydrogen thân thiện với môi trường vì sản phẩm của quá trình tiêu thụ nhiên liệu ở động cơ là nước tinh khiết mà không có chất thải nào gây hại đến môi trường, không phát thải khí CO2 gây biến đổi khí hậu toàn cầu, là nguồn năng lượng gần như vô tận và có thể tái sinh được.
- Ethanol là loại nhiên liệu sạch thay thế xăng dầu được các nhà sản xuất đánh giá cao với nhiều ưu điểm: Tạo ra lượng khí thải carbon dioxide, hydrocarbon và oxide của nitrogen thấp hơn xăng dầu. Dễ bay hơi và thải ít khí ra môi trường hơn xăng dầu. Chi phí sản xuất ethanol thấp hơn xăng dầu.
Câu hỏi trang 43 Bài tập1
Cả sulfur và sulfur dioxide đều là những chất vừa có tính oxi hoá, vừa có tính khử. Hãy viết phương trình hoá học minh hoạ.

Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.


Câu hỏi trang 43 Bài tập2
Quá trình hoà tan bột đồng bởi dung dịch sulfuric acid đặc sẽ sinh ra khí sulfur dioxide. Nhằm hạn chế phát tán sulfur dioxide ra môi trường, các hoá chất nào sau đây có thể được dùng để hấp thụ khí này: dung dịch sodium hydroxide, dung dịch nước vôi trong, dung dịch hydrochloric acid? Giải thích.

Acidic oxide phản ứng với nước tạo môi trường aicd, phản ứng với base oxide hoặc base tạo thành muối.

Sulfur dioxide thuộc loại acidic oxide. Do đó có thể dùng base là dung dịch sodium hydroxide, dung dịch nước vôi trong để hấp thụ sulfur dioxide.
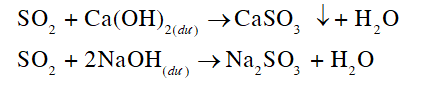
Câu hỏi trang 43 Bài tập3
Tại một số nhà máy, người ta dùng calcium oxide (vôi sống) hoặc calcium hydroxide (vôi tôi) để hấp thụ sulfur dioxide trong khí thải.
a) Viết phương trình hoá học của các phản ứng trên.
b) Ở mỗi phản ứng, sulfur dioxide thể hiện tính chất gì?

Oxide acid phản ứng với nước tạo môi trường aicd, phản ứng với base oxide hoặc base tạo thành muối.