| Câu hỏi:
4. Cho phản ứng: 2HI (g) ⇌ H2 (g) + l2(g) a) Vẽ dạng đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian. b) Xác định trên đồ thị thời điềm phản ứng trên bắt đầu đạt đến trạng thái cân bằng. 5. Cho các nhận xét sau: a) ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. b) ở trạng thái cân bằng, các chất không phản ứng với nhau. c) ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu. d) ở trạng thái cân bằng, nồng độ các chất không thay đổi. Các nhận xét đúng là: A. (a ) và (b ). B .(b ) và (c ). C . (a ) và (c). D. (a ) và (d ). |
Phương pháp giải:
4.
a) Đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian:
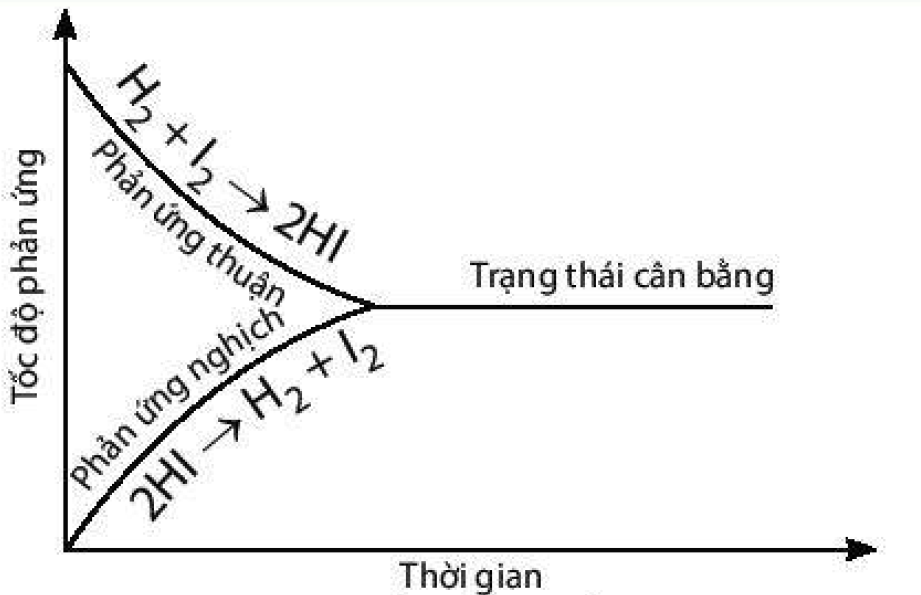
b) Thời điểm phản ứng trên bắt đầu đạt trạng thái cân bằng là thời điểm tốc độ phản ứng thuận bắt đầu bằng tốc độ phản ứng nghịch.
5.Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau đề tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau đề tạo thành các chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cân bằng, nồng độ các chất không thay đồi.

4.
a) Đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian:
Advertisements (Quảng cáo)
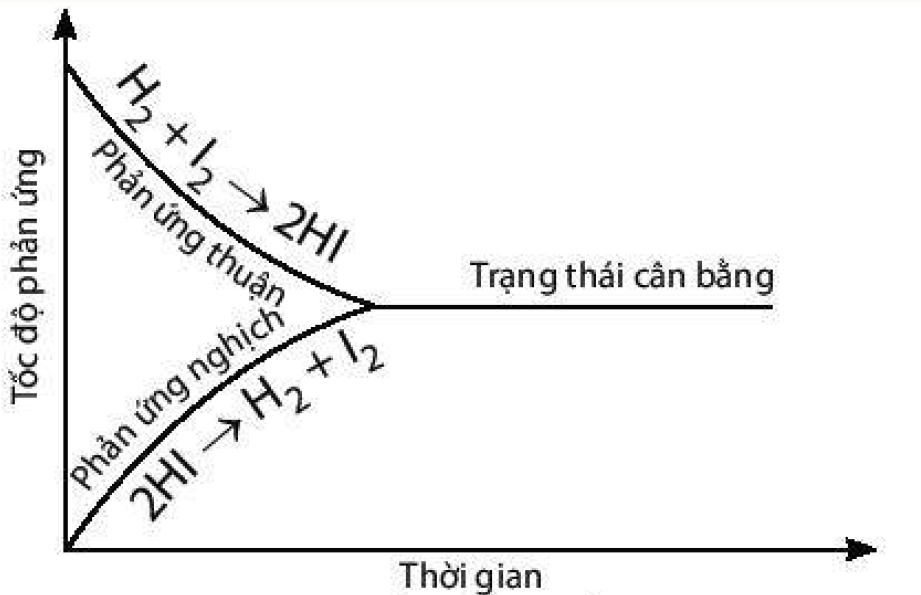
b) Điểm cân bằng của phản ứng này là điểm giao nhau giữa đường cong biểu diễn tốc độ phản ứng thuận và đường cong biểu diễn tốc độ phản ứng nghịch.
5. Các nhận xét đúng là:
a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Câu b và c sai bởi vì:
b) Ở trạng thái cân bằng, các chất không phản ứng với nhau. Là sai bởi vì các chất tham gia phản ứng liên tục phản ửng với nhau đề tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau đề tạo thành các chất đầu.
c) Ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu là sai bởi vì: nồng độ các chất ở trạng thái cân bằng có thể lớn hơn, bằng hoặc nhỏ hơn nồng độ các chất đầu.
|
Câu hỏi: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g) Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 oC với các nồng độ ban đầu khác nhau. Số liệu về nồng độ các chất ở thời điểm ban đầu và trạng thái cân bằng trong các thí nghiệm được trình bày trong Bảng 1.2. |

Áp dụng công thức \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}}\)

Giá trị hằng số cân bằng ở mỗi thí nghiệm:
- Thí nghiệm 1: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,16}^2}}}{{0,02.0,02}} = 64\)
- Thí nghiệm 2: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,18936}^2}}}{{0,00532.0,10532}} \approx 64\)
- Thí nghiệm 3: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,19420}^2}}}{{0,20290.0,00290}} \approx 64\)
Nhận xét: Hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
