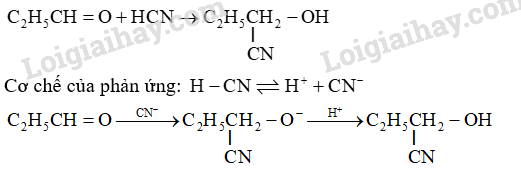Câu hỏi trang 10
Vì sao phản ứng cộng của HBr vào alkene không đối xứng lại tuân theo quy tắc Markovnikov? Các phản ứng thế bromine vào hexane, nitro hóa benzene, thủy phân dẫn xuất halogen, cộng HCN vào hợp chất carbonyl xảy ra theo cơ chế phản ứng nào?

Dựa vào phản ứng cộng electrophile vào alkene (AE)

Vì khi cộng HBr vào alkene bất đối xứng tạo nên các carbocation có độ bền khác nhau, nên phản ứng tuân theo quy tắc Markovnikov.
- Phản ứng thế bromine vào hexane theo cơ chế thế gốc (\({S_R}\)).
- Phản ứng nitro hóa benzene theo cơ chế thế electrophile (\({S_E}Ar\))
- Phản ứng thủy phân dẫn xuất halogen theo cơ chế \({S_N}1\) hoặc \({S_N}2.\)
- Phản ứng cộng HCN vào hợp chất carbonyl theo cơ chế cộng nucleophile (\({A_N}\)).
Câu hỏi trang 11 Câu hỏi
Cho các tiểu phân sau: \(^ - OH,\,{H_2}O,\,{H^ + },\,N{H_3},\,{C_2}{H_5}{O^ - },\,{C_2}{H_5}OH,\,B{r^ + },\,B{r^ - }.\) Trong các tiểu phân trên, tiểu phân nào là tác nhân electrophile, tiểu phân nào là tác nhân nucleophile?

Dựa vào phản ứng thế gốc của alkane (SR)

Tác nhân electrophile: \({H^ + },B{r^ + }.\)
Tác nhân nucleophile: \(^ - OH,\,{H_2}O,\,N{H_3},\,{C_2}{H_5}{O^ - },\,{C_2}{H_5}OH,\,B{r^ - }.\)
Câu hỏi trang 11 Luyện tập (LT)
Giải thích vì sao khi cho propane phản ứng với chlorine khi có ánh sáng thì thu được sản phẩm chính là 2-chloropropane.

Dựa vào phản ứng thế gốc của alkane SR.

Giải thích: Do gốc tự do \(C{H_3} - \mathop C\limits^ \bullet H - C{H_3}\) bền hơn gốc tự do \(C{H_3} - C{H_2} - \mathop C\limits^ \bullet {H_2}\) nên sản phẩm chính thu được khi cho propane phản ứng với chlorine khi có ánh sáng là 2-chloropropane.
Câu hỏi trang 12 Luyện tập (LT) 1
Viết cơ chế để giải thích quá trình tạo thành các sản phẩm của phản ứng giữa propene với bromine.

Dựa vào cơ chế phản ứng của phản ứng cộng.

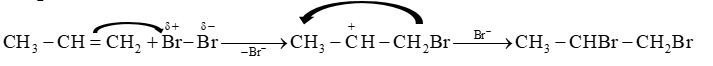
Câu hỏi trang 12 Luyện tập (LT) 2
Giải thích vì sao propene cộng hợp với HBr lại sinh ra sản phẩm chính là 2-bromopropene (theo quy tắc Markovnikov).

Dựa vào phản ứng cộng.

Giải thích: Do carbocation \(C{H_3} - \mathop C\limits^ + H - C{H_3}\) bền hơn carbocation \(C{H_3} - C{H_2} - \mathop C\limits^ + {H_2}\) nên sản phẩm chính thu được khi cho propene cộng hợp với HBr lại sinh ra sản phẩm chính là 2-bromopropene (theo quy tắc Markovnikov).
Câu hỏi trang 13
Viết phương trình hóa học của phản ứng cộng nước của propene (xúc tác ). Giải thích quá trình tạo ra sản phẩm bằng cơ chế phản ứng. Chỉ ra sản phẩm chính của phản ứng. Giải thích.

Dựa vào phản ứng của alkene với nước.


* Sản phẩm chính của phản ứng là \(C{H_3} - CH(OH) - C{H_3}\) do carbocation \(C{H_3} - \mathop C\limits^ + H - C{H_3}\) bền hơn carbocation \(C{H_3} - C{H_2} - \mathop C\limits^ + {H_2}\).
Câu hỏi trang 15 Luyện tập (LT) 1
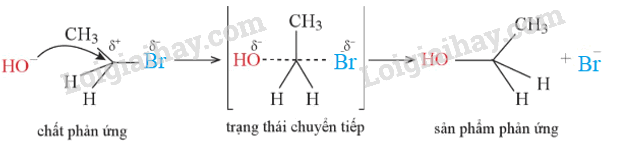
Viết cơ chế của phản ứng thủy phân bromoethane trong dung dịch kiềm.

Dựa vào phản ứng thể nucleophile.

\(NaOH \to N{a^ + } + O{H^ - }\)
Câu hỏi trang 15 Luyện tập (LT) 2
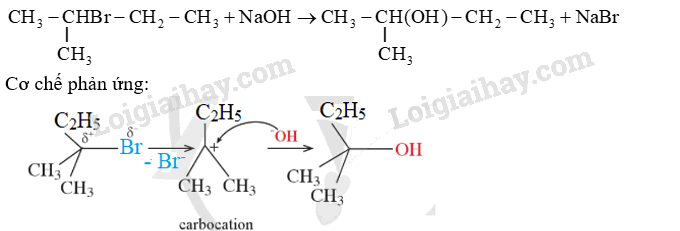
Viết phương trình hóa học của phản ứng thủy phân 2-bromo-2-methylbutane trong dung dịch sodium hydroxide. Giải thích quá trình tạo ra sản phẩm bằng cơ chế phản ứng.

Dựa vào phản ứng thế nucleophile.
Advertisements (Quảng cáo)

Câu hỏi trang 16 Luyện tập (LT) 1
Viết phương trình hóa học của phản ứng giữa acetone và HCN. Giải thích quá trình tạo ra sản phẩm bằng cơ chế phản ứng.

Dựa vào phản ứng cộng electrophile.

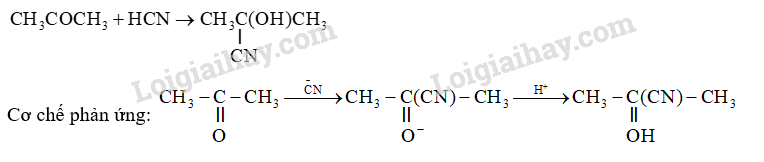
Câu hỏi trang 16 Luyện tập (LT) 2
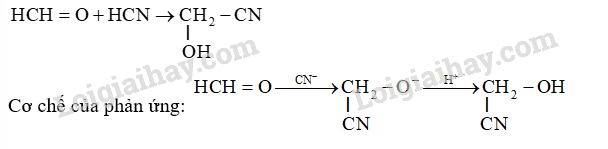
Cho biết HCHO có khả năng phản ứng với HCN không. Nếu có, viết phương trình hóa học của phản ứng xảy ra và viết cơ chế để giải thích quá trình hình thành sản phẩm.

Dựa vào phản ứng cộng electrophile.

Trong các phản ứng hóa học hữu cơ, các tiểu phân sau đây có thể là tác nhân electrophile hay tác nhân nucleophile?
a) \(C{H_3}{O^ - }\) b) \({(C{H_3})_2}\mathop C\limits^ + H\) c) \({(C{H_3})_3}N\)

Dựa vào tác nhân electrophile và tác nhân nucleophile.

a) \(C{H_3}{O^ - }\) là tác nhân nucleophile.
b) \({(C{H_3})_2}\mathop C\limits^ + H\) là tác nhân electrophile.
c) \({(C{H_3})_3}N\) là tác nhân nucleophile.
Viết phương trình hóa học của phản ứng giữa hexane với bromine (khi chiếu sáng hoặc đun nóng). Viết cơ chế để giải thích quá trình tạo thành sản phẩm monobromohexane bằng cơ chế phản ứng.

Dựa vào phản ứng thế gốc nucleophile.

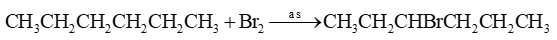
Cơ chế của phản ứng:
Giai đoạn khơi mào: 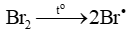
Giai đoạn phát triển mạch:
\(B{r^ \bullet } + {C_6}{H_{14}} \to HBr + {\mathop C\limits^ \bullet _6}{H_{13}}\)
\({\mathop C\limits^ \bullet _6}{H_{13}} + B{r_2} \to {C_6}{H_{13}}Br + B{r^ \bullet }\)
Giai đoạn tắt mạch:
\(\begin{array}{l}2B{r^ \bullet } \to B{r_2}\\B{r^ \bullet } + {\mathop C\limits^ \bullet _6}{H_{13}} \to {C_6}{H_{13}}Br\\{\mathop C\limits^ \bullet _6}{H_{13}} + {\mathop C\limits^ \bullet _6}{H_{13}} \to {C_{12}}{H_{26}}\end{array}\)
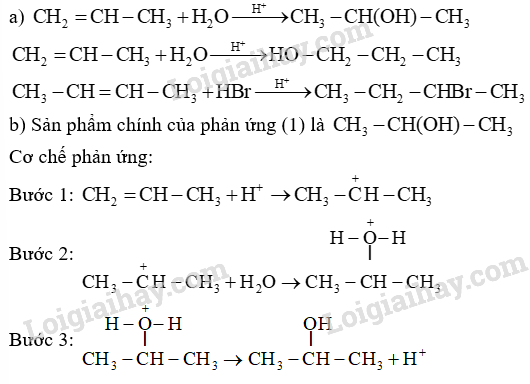
Cho các phản ứng sau:
(1) Propene phản ứng với (xúc tác acid).
(2) But-2-ene phản ứng với HBr.
a) Dùng công thức cấu tạo, viết phương trình hóa học của phản ứng xảy ra.
b) Hãy cho biết sản phẩm chính của phản ứng (1). Viết cơ chế để giải thích quá trình hình thành sản phẩm chính.

Dựa vào phản ứng cộng của alkene.

Viết phương trình hóa học của phản ứng xảy ra giữa \({C_2}{H_5}CHO\) và HCN. Viết cơ chế của phản ứng để giải thích quá trình hình thành sản phẩm.

Dựa vào phản ứng thế nucleophile.