Câu hỏi/bài tập:
Nhiệt độ sôi của một số chất thể hiện trong biểu đồ:
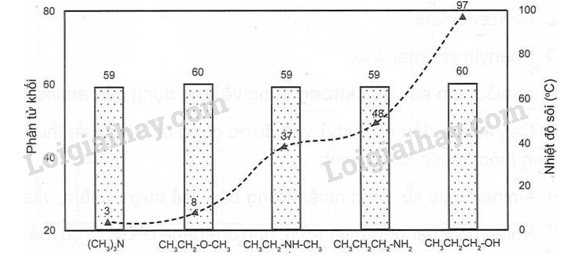
a) So sánh nhiệt độ sôi của các chất có phân tử khối tương đương.
b) Dựa vào khả năng hình thành liên kết hydrogen của amine, hãy giải thích:
- Vì sao (CH3)3N có nhiệt độ sôi thấp nhất trong 3 amine?
- Vì sao CH3CH2CH2NH2 có nhiệt độ sôi cao hơn CH3CH2NHCH3?
Advertisements (Quảng cáo)
- Vì sao CH3CH2CH2NH2 có nhiệt độ sôi thấp hơn CH3CH2CH2OH?

Dựa vào tính chất vật lí của amine.

a) Các chất có PTK tương đương (lần lượt là trimethylamine, M = 59; ethylmethylether, M =60, ethylmethylamine, M = 59, propyamine, M = 59, propyl alcohol, M =60) nhưng nhiệt độ sôi rất khác nhau, tăng dần từ trimethylamine (có nhiệt độ sôi nhỏ nhất 3oC) đến propyl alcohol (có nhiệt độ sôi lớn nhất 97oC)
b) So với 2 amine CH3CH2NHCH3 và CH3CH2CH2NH2 thì (CH3)3N không hình thành được liên kết Hydrogen liên phân tử, dẫn đến nhiệt độ sôi của (CH3)3N sẽ nhỏ hơn.
Nhóm -NH2 của CH3CH2CH2NH2 có nhiều Hydrogen linh động nên tạo nên được nhiều liên kết Hydrogen hơn so với nhóm -NH- của CH3CH2NHCH3
Nitrogen có độ âm điện (3,04) nhỏ hơn Oxygen (3,44) nên nhóm -NH2 của CH3CH2CH2NH2 hình thành liên kết Hydrogen kém bền hơn so với liên kết Hydrogen được hình thành nhóm -OH của CH3CH2CH2OH.
