Câu hỏi trang 116
Trong nhóm IIA, magnesium và calcium là hai nguyên tố phổ biến nhất, đồng thời có vai trò quan trọng với sự sinh trưởng, phát triển của động vật và thực vật. Magnesium có trong chất diệp lục, calcium có trong vỏ và mai các loài giáp xác, trong xương và răng của người và động vật,... Ngoài ra, đơn chất và hợp chất nhóm IIA có nhiều ứng dụng phổ biến trong đời sống, sản xuất. Vậy, đơn chất nhóm IIA có đặc điểm gì nổi bật về tính chất vật lý và tính chất hoá học? Các hợp chất phổ biến của calcium có vai trò như thế nào với đời sống, sản xuất và cơ thể con người?

- Nêu tính chất vật lý và tính chất hóa học của kim loại nhóm IIA.
- Ứng dụng của các hợp chất của calcium.

- Kim loại nhóm IIA:
+ Tính chất vật lí: Nhiệt độ nóng chảy, khối lượng riêng và độ cứng của kim loại nhóm IIA cao hơn so với kim loại nhóm IA cùng chu kì. Kim loại nhóm IIA là những kim loại nhẹ (D 3).
+ Tính chất hóa học: Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dần từ Be đến Ba.
\({\rm{M}} \to {{\rm{M}}^{2 + }} + 2{\mathop{\rm e}\nolimits} \)
- Ứng dụng của các hợp chất của calcium:

Câu hỏi trang 117 Hoạt động (HĐ)
Một số đại lượng đặc trưng của các nguyên tố nhóm IIA được trình bày trong Bảng 25.1.
Thực hiện các yêu cầu sau:
1. Nhận xét xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IIA.
2. Dựa vào bán kính nguyên tử, điện tích hạt nhân, dự đoán xu hướng biến đổi tính khử từ Be đến Ba.
3. Dự đoán số oxi hoá đặc trưng của nguyên tử của nguyên tố nhóm IIA. Giải thích.

Dựa vào các thông tin được đưa ra trong Bảng 25.1
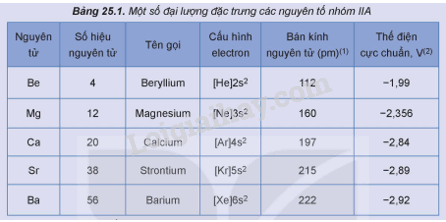

1. Bán kính nguyên tử tăng dần từ Be đến Ba.
2. Xét các nguyên tố nhóm IIA, khi đi theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần từ Be đến Ba, do đó khả năng cho các electron ở lớp ngoài cùng tăng, dẫn đến tính kim loại (tính khử) tăng từ Be đến Ba.
3. Kim loại nhóm IIA có 2 electron lớp ngoài cùng nên khi tham gia liên kết hóa học nguyên tử của các nguyên tố nhóm IIA nhường electron để có cấu hình bền của khí hiếm. Do đó điện tích duy nhất của các kim loại nhóm IIA là 2+, nên trong hợp chất số oxi hóa của chúng là +2.
Câu hỏi trang 117 Câu hỏi
Tại sao trong tự nhiên, các nguyên tố nhóm IIA chỉ tồn tại ở dạng hợp chất?

Kim loại nhóm IIA có giá trị thế điện cực chuẩn nhỏ.

Vì kim loại nhóm IIA có giá trị thế điện cực chuẩn nhỏ nên các kim loại nhóm IIA có tính khử mạnh hay nói cách khác là kim loại nhóm IIA hoạt động hóa học mạnh, chúng dễ dàng kết hợp với những chất khác để tạo thành hợp chất. Do đó trong tự nhiên kim loại nhóm lA chỉ tồn tại ở dạng hợp chất.
Câu hỏi trang 118
Một số thông số vật lý của kim loại nhóm IIA được trình bày trong Bảng 25.2.
Thực hiện các yêu cầu sau:
1. So sánh nhiệt độ nóng chảy của kim loại nhóm IIA với kim loại nhóm IA trong cùng chu kì.
2. Trong nhóm IIA, kim loại nào là kim loại nhẹ?

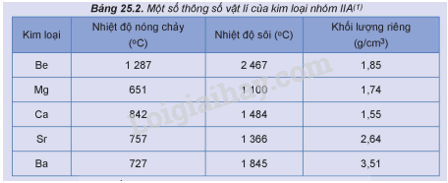

1. Kim loại nhóm IIA có nhiệt độ nóng chảy cao hơn so với kim loại nhóm IA trong cùng chu kì.
2. Tất cả các kim loại nhóm IIA đều có khối lượng riêng nhỏ hơn 5g/cm3 nên các kim loại nhóm IIA là kim loại nhẹ.
Câu hỏi trang 120 Hoạt động (HĐ) 1
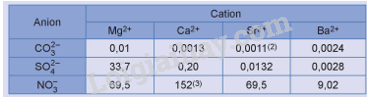
Độ tan (g/100 g nước) của các muối sulfate, carbonate và nitrate của kim loại nhóm IIA ở 20 °C(1) cho trong bảng sau:
Thực hiện yêu cầu sau:
Nhận xét về khả năng hoà tan (dễ tan/ít tan/không tan) của các muối của kim loại nhóm IIA.

Độ tan của chất: S (g/100g ở H2O ở nhiệt độ thường).
• Chất tan: S > 1,0.
• Chất ít tan: 0,01
• Chất không tan: S ≤ 0,01.

- Muối carbonate của kim loại nhóm IIA không tan.
- Muối sulfate của Mg tan, muối sulfate của Ca và Sr ít tan, muối sulfate của Ba không tan.
- Muối nitrate của kim loại nhóm IIA đều tan.
Câu hỏi trang 120 Hoạt động (HĐ) 2
Thí nghiệm: So sánh độ tan giữa calcium sulfate và barium sulfate
- Chuẩn bị:
+ Hoá chất: các dung dịch CaCl2 1 M, BaCl2 1 M, CuSO4 1M.
+ Dụng cụ: ống nghiệm, giá ống nghiệm.
- Tiến hành:
+ Đặt 2 ống nghiệm vào giá. Thêm khoảng 2 mL dung dịch CaCl2 vào ống nghiệm (1), 2 mL dung dịch BaCl2 vào ống nghiệm (2).
+ Nhỏ từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm cho đến khi xuất hiệnkết tủa.
- Quan sát hiện tượng xảy ra và thực hiện yêu cầu sau:
So sánh thời điểm xuất hiện kết tủa ở hai ống nghiệm và giải thích.

CaSO4 ít tan; BaSO4 không tan.

- Hiện tượng: Ống nghiệm (1) chứa kết tủa CaSO4 xuất hiện kết tủa chậm hơn so với ống nghiệm (2) chứa kết tủa BaSO4.
- Giải thích: Vì CaSO4 ít tan, BaSO4 không tan nên kết tủa CaSO4 xuất hiện kết tủa chậm hơn so với kết tủa BaSO4.
Câu hỏi trang 121 Câu hỏi
Đề xuất cách phân biệt ba dung dịch bão hoà: CaCl2, SrCl2, BaCl2.

Khi đốt nóng các kim loại nhóm IIA hoặc hợp chất của chúng trong ngọn lửa không màu làm ngọn lửa có màu đặc trưng: Ca2+ màu đỏ cam, Sr2+ màu đỏ son, Ba2+ màu lục.

- Trích các dung dịch trên làm mẫu thử và đánh số thứ tự.
- Nhúng đầu dây inox sạch vào một mẫu thử, rồi đưa vào ngọn lửa không màu của đèn khí. Lặp lại tương tự với mẫu thử còn lại:
+ Mẫu thử nào cháy cho ngọn lửa đỏ cam chứa dung dịch CaCl2.
+ Mẫu thử nào cháy cho ngọn lửa đỏ son chứa dung dịch SrCl2.
+ Mẫu thử nào cháy cho ngọn lửa màu lục chứa dung dịch BaCl2.
Câu hỏi trang 121 Hoạt động (HĐ) 1
Muối carbonate của kim loại nhóm IIA là muối của acid yếu, tác dụng được với nhiều acid vô cơ và hữu cơ, giải phóng khí carbon dioxide.
1. Viết phương trình hoá học của phản ứng giữa CaCO3 với dung dịch HCl, với dung dịch CH3COOH.
2. Đề xuất cách làm sạch cặn đá vôi trong phích nước.

Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dần từ Be đến Ba.
\({\rm{M}} \to {{\rm{M}}^{2 + }} + 2{\mathop{\rm e}\nolimits} \)

1. Phương trình hóa học:
\({\rm{CaC}}{{\rm{O}}_{\rm{3}}} + 2{\rm{HCl}} \to {\rm{CaC}}{{\rm{l}}_{\rm{2}}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
\({\rm{CaC}}{{\rm{O}}_{\rm{3}}} + 2{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}} \to {({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}})_2}{\rm{Ca}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
2. Để làm sạch cặn đá vôi trong phích nước, ta sử dụng giấm ăn. Trong giấm ăn có chứa acetic acid, hòa tan được cặn đá vôi (CaCO3) trong phích.
Câu hỏi trang 121 Hoạt động (HĐ) 2
Các muối carbonate của kim loại nhóm IIA đều bị phân huỷ bởi nhiệt:
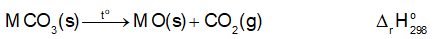
Advertisements (Quảng cáo)
Biến thiên enthalpy chuẩn của quá trình trên được cho trong bảng sau

Thực hiện các yêu cầu sau:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán xu hướng biến đổi độ bền nhiệt của các muối carbonate của kim loại nhóm IIA.

Biến thiên enthalpy của phản ứng có giá trị âm. Biến thiên enthalpy càng âm, phản ứng tỏa ra càng nhiều nhiệt.
Biến thiên enthalpy của phản ứng có giá trị dương. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.

Độ bền nhiệt của muối carbonate càng lớn, biến thiên enthalpy của phản ứng nhiệt phân muối carbonate càng lớn.
=> Độ bền nhiệt của muối carbonate của kim loại nhóm IIA có xu hướng tăng dần từ muối của MgCO3 đến muối của BaCO3.
Câu hỏi trang 122 Hoạt động (HĐ) 1
Biến thiên enthalpy chuẩn của phản ứng nhiệt phân các muối nitrate của kim loại nhóm IIA:
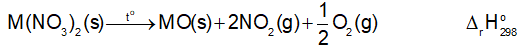
Cho trong bảng sau:

Thực hiện yêu cầu sau:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán xu hướng biến đổi độ bền nhiệt của muối nitrate của kim loại nhóm IIA.

Biến thiên enthalpy của phản ứng có giá trị âm. Biến thiên enthalpy càng âm, phản ứng tỏa ra càng nhiều nhiệt.
Biến thiên enthalpy của phản ứng có giá trị dương. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.

Độ bền nhiệt của muối nitrate càng lớn, biến thiên enthalpy của phản ứng nhiệt phân muối nitrate càng lớn.
=>Độ bền nhiệt của muối nitrate của kim loại nhóm IIA có xu hướng tăng dần từ muối của Mg(NO3)2 đến muối của Ba(NO3)2.
Câu hỏi trang 122 Hoạt động (HĐ) 2
Nhận biết từng ion riêng rẽ Ca2+, Ba2+, \({\rm{SO}}_4^{2 - }\)
- Cho vào ống nghiệm (1) khoảng 1 mL dung dịch CaCl2 1 M, ống nghiệm (2) khoảng 1 mL dung dịch BaCl2 1 M, ông nghiệm (3) khoảng 1 mL Na2SO4 1 M.
- Nhỏ từ từ từng giọt dung dịch Na2SO4 1 M vào mỗi ống nghiệm (1) và ống nghiệm (2); nhỏ vài giọt dung dịch BaCl2 1 M vào ống nghiệm (3).
Chú ý: BaCl2 độc, cần tuân thủ quy tắc an toàn trong phòng thí nghiệm.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong mỗi ống nghiệm.
2. Ở ống nghiệm (1) và (2), ống nào tạo kết tủa nhanh hơn? Nhiều hơn?

Kiểm tra sự có mặt của ion Ca2+, Ba2+, \({\rm{SO}}_4^{2 - }\), \({\rm{CO}}_3^{2 - }\)trong dung dịch thông qua phản ứng trao đổi để tạo thành kết tủa CaSO4, BaSO4 và CaCO3.

1. Ống nghiệm (1): \({\rm{CaC}}{{\rm{l}}_{\rm{2}}} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_4} \to {\rm{CaS}}{{\rm{O}}_4} \downarrow + 2{\rm{NaCl}}\)
Ống nghiệm (2): \({\rm{BaC}}{{\rm{l}}_{\rm{2}}} + {{\mathop{\rm Na}\nolimits} _2}S{O_4} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow + 2{\rm{NaCl}}\)
Ống nghiệm (3): \({{\mathop{\rm Na}\nolimits} _2}S{O_4} + {\rm{BaC}}{{\rm{l}}_{\rm{2}}} \to 2{\rm{NaCl}} + {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow \)
2. Ống nghiệm (2) tạo kết tủa BaSO4 nhanh hơn và nhiều ống nghiệm (1) tạo kết tủa CaSO4.
Câu hỏi trang 122 Hoạt động (HĐ) 3
Nhận biết ion \({\rm{CO}}_3^{2 - }\)
- Cho khoảng 1 mL dung dịch Na2CO3 1 M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl2 1 M, lắc đều.
- Thêm tiếp 2 mL dung dịch HCl 2 M vào ống nghiệm, lắc đều.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.
2. Nêu các hiện tượng xảy ra và giải thích.

Kiểm tra sự có mặt của ion Ca2+, Ba2+, \({\rm{SO}}_4^{2 - }\), \({\rm{CO}}_3^{2 - }\)trong dung dịch thông qua phản ứng trao đổi để tạo thành kết tủa CaSO4, BaSO4 và CaCO3.

1. Phương trình hóa học:
\({\rm{CaC}}{{\rm{l}}_{\rm{2}}} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}} \to {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \downarrow + 2{\rm{NaCl}}\)
\({\rm{CaC}}{{\rm{O}}_{\rm{3}}} + 2{\rm{HCl}} \to {\rm{CaC}}{{\rm{l}}_{\rm{2}}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
2. Hiện tượng: Xuất hiện kết tủa trắng CaCO3, sau đó kết tủa tan và xuất hiện bọt khí CO2 không màu.
Giải thích: Muối calcium carbonate là muối của acid yếu, tác dụng được với nhiều acid mạnh, giải phóng khí carbon dioxide.
Câu hỏi trang 123
Tìm hiểu và trình bày vai trò của calcium trong cơ thể con người mà em biết.

Dựa vào SGK trang 123

Calcium giúp xương chắc khỏe, phòng ngừa những bệnh loãng xương, giảm tình trạng đau nhức và khó khăn trong vận động, làm nhanh lành các vết nứt gãy trên xương.
Câu hỏi trang 124 Câu hỏi 1
a) Khi đun nóng nước có tính cứng tạm thời, phần lớn các ion Ca2+ và Mg2+ được tách ra khỏi nước ở dạng kết tủa muối carbonate.Viết phương trình hoá học của các phản ứng xảy ra.
b) Giải thích sự tạo thành cặn đá vôi trong phích nước, ấm đun nước.

Muối hydrogencarbnate bị nhiệt phân hủy tạo muối carbonate, khí carbon dioxide và nước.

a) Phương trình hóa học:
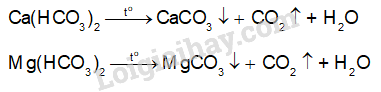
b) Trong nước chứa các muối hydrogencarbonate của kim loại Ca, muối này dễ bị phân hủy bởi nhiệt và tạo thành các lớp cặn đá vôi chứa CaCO3 trong phích nước nóng, ấm đun nước.
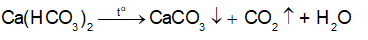
Câu hỏi trang 124 Câu hỏi 2
Trình bày về tác hại của nước cứng với sản xuất và đời sống.

Dựa vào thông tin mục 2 trang 124, sách giáo khoa.

Một số tác hại của nước cứng.
- Nồi hơi dễ bị đóng cặn gây tốn nhiên liệu và không an toàn.
- Đường ống dẫn nước dễ bị đóng cặn làm giảm lưu lượng nước hoặc tắc đường ống.
- Giặt bằng xà phòng sẽ tạo ra muối ít tan bám vào quần áo, xà phòng tạo ít bọt, tốn xà phòng, quần áo mau hỏng.
- Nấu ăn bằng nước cứng làm cho thực phẩm lâu chín, giảm mùi vị.
Câu hỏi trang 124 Hoạt động (HĐ)
1. Đề xuất hai cách (không dùng hoá chất và có dùng hoá chất) để làm mềm mẫu nước có tính cứng tạm thời chứa Ca(HCO3)2 và Mg(HCO3)2. Viết phương trình hoá học để minh họa.
2. Đề xuất hai hoá chất có thể dùng để làm mềm mẫu nước có tính cứng vĩnh cửu chứa CaCl2 và MgSO4. Giải thích.

Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các cation Ca2+ và Mg2+ trong nước cứng. Có hai phương pháp làm mềm nước cứng phổ biến: chuyển các cation Ca2+ và Mg2+ vào hợp chất không tan (phương pháp kết tủa) và thay thế những cation này bằng các cation khác (phương pháp trao đổi ion).

1. Cách 1: Đun nóng nước có tính cứng tạm thời để làm mềm nước
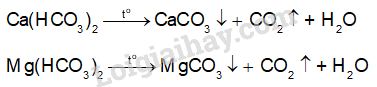
Cách 2: Sử dụng dung dịch Na2CO3
\({\rm{Ca(HC}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_3} \to {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \downarrow + {\rm{ }}2{\rm{NaHC}}{{\rm{O}}_{\rm{3}}}\)
\({\rm{Mg(HC}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_3} \to {\rm{MgC}}{{\rm{O}}_{\rm{3}}} \downarrow + {\rm{ }}2{\rm{NaHC}}{{\rm{O}}_{\rm{3}}}\)
2. Để làm mềm nước cứng vĩnh cửu chứa CaCl2 và MgSO4 ta có thể sử dụng Na2CO3 hoặc Na3PO4. Ca2+ và Mg2+ phản ứng tạo kết tủa với \({\rm{CO}}_3^{2 - }\)và \({\rm{PO}}_4^{3 - }\), làm giảm nồng độ các cation Ca2+ và Mg2+ trong nước cứng.
\({\rm{C}}{{\rm{a}}^{2 + }} + {\rm{CO}}_3^ - \to {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \downarrow \);
\({\rm{3C}}{{\rm{a}}^{2 + }} + 2{\rm{PO}}_4^{3 - } \to {\rm{C}}{{\rm{a}}_3}{{\rm{(P}}{{\rm{O}}_4})_2} \downarrow \)
\({\rm{M}}{{\rm{g}}^{2 + }} + {\rm{CO}}_3^ - \to {\rm{MgC}}{{\rm{O}}_{\rm{3}}} \downarrow \);
\({\rm{3M}}{{\rm{g}}^{2 + }} + 2{\rm{PO}}_4^{3 - } \to {\rm{M}}{{\rm{g}}_3}{{\rm{(P}}{{\rm{O}}_4})_2} \downarrow \)
