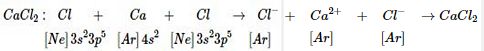Trình bày nội dung các quy tắc bát tử. Vận dụng quy tắc bát tử để giải thích sự hình thành liên kết ion trong các phân tử: Li, KBr, , \(CaC{l_2}.\)

Quy tắc bát tử: Nguyên tử của nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình electron bền vững của các khí hiếm với 8 electron (hoặc 2 electron đối với heli) ở lớp ngoài cùng.
Advertisements (Quảng cáo)
Sự hình thành liên kết trong LiF, KBr, \(CaC{l_2}\) được giải thích ngắn gọn bằng sơ đồ sau:
\(\eqalign{ &LiF:\,\,\,\,\,\,Li\,\,\,\,\, + \,\,\,\,\,\,F\,\,\,\,\,\,\,\, \to \,\,\,\,\,L{i^ + }+ \,\,\,{F^ - }\,\,\,\to LiF. \cr & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,1{s^2}2{s^1}\,\,\,\,\,\,1{s^2}2{s^2}2{p^5}\,\,\,\,\,\,\,\,\,\,\,1{s^2}\,\,\,\,\,\,1{s^2}2{s^2}2{p^6} \cr& KBr:\,K\,\,\,+ \,\,\,\,\,Br\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,{K^ + }\,\,\,\,+ \,\,B{r^ - } \to KBr \cr& \,\,\,\,\,\,\,\,\,\,\,\left[ {Ar} \right]4{s^1}\,\,\,\left[ {Ar} \right]3{d^{10}}4{s^2}4{p^5}\,\,\,\,\left[ {Ar} \right]\,\,\,\,\,\,\,\left[ {Kr} \right] \cr} \)