16.1
Khi tăng nồng độ chất tham gia, thì
A. tốc độ phản ứng tăng.
B. tốc độ phản ứng giảm.
C. không ảnh hưởng đến tốc độ phản ứng.
D. có thể tăng hoặc giảm tốc độ phản ứng.

Dựa vào khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng

- Đáp án: A
16.2
Yếu tố nào sau đây làm giảm tốc độ phản ứng:
A. Sử dụng enzyme cho phản ứng.
B. Thêm chất ức chế vào hỗn hợp chất tham gia.
C. Tăng nồng độ chất tham gia.
D. Nghiền chất tham gia dạng khối thành bột.

Dựa vào chất ức chế làm giảm tốc độ phản ứng

- Đáp án: B
16.3
Các enzyme là chất xúc tác, có chức năng:
A. Giảm năng lượng hoạt hoá của phản ứng.
B. Tăng năng lượng hoạt hoá của phản ứng.
C. Tăng nhiệt độ của phản ứng.
D. Giảm nhiệt độ của phản ứng.

Dựa vào chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc

- Đáp án: A
16.4
Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng:
A. Nhiệt độ chất phản ứng.
B. Thể vật lý của chất phản ứng (rắn, lỏng, kích thước lớn, nhỏ,...).
C. Nồng độ chất phản ứng.
D. Tỉ trọng của chất phản ứng.

Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Khi tăng áp suất (đối với phản ứng có chất khí), tốc độ phản ứng tăng
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc

- Đáp án: D
16.5
Sản phẩm của phản ứng được tạo ra qua các bước theo hình bên dưới:
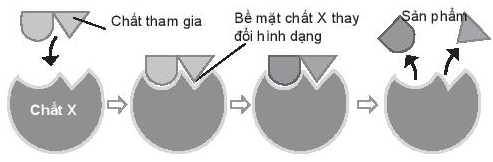
Vai trò của chất X là
A. chất xúc tác.
B. làm tăng năng lượng hoạt hoá của chất tham gia phản ứng.
C. làm giảm năng lượng hoạt hoá của chất tham gia phản ứng.
D. làm tăng nồng độ chất tham gia phản ứng.

Dựa vào chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc

- Đáp án: C
16.6
Tốc độ của một phản ứng hoá học
A. chỉ phụ thuộc vào nồng độ các chất tham gia phản ứng.
B. tăng khi nhiệt độ của phản ứng tăng.
C. càng nhanh khi giá trị năng lượng hoạt hoá càng lớn.
D. không phụ thuộc vào diện tích bề mặt.

Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Khi tăng áp suất (đối với phản ứng có chất khí), tốc độ phản ứng tăng
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc

- Đáp án: B
16.7
Hoàn thành bảng sau, cho biết mỗi thay đổi sẽ làm tăng hay giảm tốc độ của phản ứng
|
Yếu tố ảnh hưởng |
Tốc độ phản ứng |
|
Đun nóng chất tham gia |
Tăng |
|
Thêm xúc tác phù hợp |
|
|
Pha loãng dung dịch |
|
|
Ngưng dùng enzyme (chất xúc tác) |
|
|
Giảm nhiệt độ |
|
|
Tăng nhiệt độ |
|
|
Giảm diện tích bề mặt |
|
|
Tăng nồng độ chất phản ứng |
|
|
Chia nhỏ chất phản ứng thành mảnh nhỏ |
|

Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Khi tăng áp suất (đối với phản ứng có chất khí), tốc độ phản ứng tăng
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc

|
Yếu tố ảnh hưởng |
Tốc độ phản ứng |
|
Đun nóng chất tham gia |
Tăng |
|
Thêm xúc tác phù hợp |
Tăng |
|
Pha loãng dung dịch |
Giảm |
|
Ngưng dùng enzyme (chất xúc tác) |
Giảm |
|
Giảm nhiệt độ |
Giảm |
|
Tăng nhiệt độ |
Tăng |
|
Giảm diện tích bề mặt |
Giảm |
|
Tăng nồng độ chất phản ứng |
Tăng |
|
Chia nhỏ chất phản ứng thành mảnh nhỏ |
Tăng |
16.8
Có 3 phương pháp chính được sử dụng để tăng tốc độ của phản ứng hoá học: tăng nồng độ, tăng nhiệt độ và thêm chất xúc tác. Theo lý thuyết va chạm, hãy giải thích 3 phương pháp đó.

Dựa vào nội dung thuyết va chạm: các phân tử/ nguyên tử va chạm với nhau càng nhiều thì số va chạm hiệu quả sẽ tăng nên tốc độ phản ứng tăng

- Khi tăng nồng độ, các chất tham gia phản ứng sẽ có nhiều phân tử/ nguyên tử hơn trong cùng một diện tích => Tạo ra nhiều va chạm hiệu quả hơn => Tốc độ phản ứng tăng
- Khi tăng nhiệt độ, các chất tham gia phản ứng sẽ được cung cấp thêm năng lượng => Các phân tử/ nguyên tử của chúng chuyển động nhanh và nhiều hơn => Tạo ra nhiều va chạm hiệu quả hơn => Tốc độ phản ứng tăng
- Khi thêm chất xúc tác, chất xúc tác sẽ làm giảm năng lượng hoạt hóa của chất tham gia phản ứng => Phản ứng xảy ra dễ hơn => Tốc độ phản ứng tăng
16.9
Hoàn thành bảng sau, cho biết yếu tố chính ảnh hưởng đến tốc độ phản ứng trong từng trường hợp
|
Tình huống |
Yếu tố ảnh hưởng |
|
Duy trì thổi không khí vào bếp để than cháy đều |
|
|
Than đá được nghiền nhỏ dùng trong quá trình luyện kim loại |
|
|
Thức ăn được tiêu hóa trong dạ dày nhờ acid và enzyme |
|
|
Xác của một số loài động vật được bảo quản nguyên vẹn ở Bắc cực và Nam cực hàng ngàn năm |
|
|
Vụ nổ bụi xảy ra tại một xưởng cưa |

|
Tình huống |
Yếu tố ảnh hưởng |
|
Duy trì thổi không khí vào bếp để than cháy đều |
Nồng độ |
|
Than đá được nghiền nhỏ dùng trong quá trình luyện kim loại |
Diện tích tiếp xúc |
|
Thức ăn được tiêu hóa trong dạ dày nhờ acid và enzyme |
Chất xúc tác |
|
Xác của một số loài động vật được bảo quản nguyên vẹn ở Bắc cực và Nam cực hàng ngàn năm |
Nhiệt độ |
|
Vụ nổ bụi xảy ra tại một xưởng cưa |
Bề mặt tiếp xúc và nồng độ |
16.10
Trong thí nghiệm 3 (SGK trang 102), người ta cân khối lượng chất rắn trước và sau phản ứng thấy không đổi, chứng tỏ chất xúc tác có tham gia như là một chất phản ứng không? Giải thích.

Dựa vào chất phản ứng sẽ giảm dần về lượng và biến đổi về chất theo thời gian và chất xúc tác vẫn giữ nguyên về lượng và chất theo thời gian

- Khối lượng chất rắn trước và sau phản ứng không thay đổi => Như vậy MnO2 là chất xúc tác vì không bị biến đổi cả về lượng và chất trước và sau phản ứng
16.11
Tốc độ các phản ứng sau chịu ảnh hưởng của yếu tố nào?
a) Than củi đang cháy, dùng quạt thổi thêm không khí vào, sự chảy diễn ra mạnh hơn.
b) Phản ứng oxi hoá SO2 thành SO3 diễn ra nhanh hơn khi có mặt của V2O5.
c) Aluminium dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với aluminium dạng lá.
d) Để thực phẩm trong tủ lạnh giúp cho thực phẩm được tươi lâu hơn.
e) Sử dụng nồi áp suất để hầm thức ăn giúp thức ăn nhanh chín.
g) Sử dụng các loại men thích hợp để làm sữa chua, lên men rượu, giấm,…

a) Nhiệt độ
b) Chất xúc tác
c) Bề mặt diện tích tiếp xúc
d) Nhiệt độ
e) Nhiệt độ
g) Chất xúc tác

a) Than củi đang cháy, dùng quạt thổi thêm không khí vào, sự chảy diễn ra mạnh hơn. => Ảnh hưởng bởi yếu tố nồng độ vì để duy trì sự cháy cần khí oxygen, thổi thêm không khí vào là cung cấp thêm khí oxygen
b) Phản ứng oxi hoá SO2 thành SO3 diễn ra nhanh hơn khi có mặt của V2O5. => Ảnh hưởng bởi yếu tố chất xúc tác vì V2O5 làm cho phản ứng dễ xảy ra hơn
Advertisements (Quảng cáo)
c) Aluminium dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với aluminium dạng lá. => Ảnh hưởng bởi yếu tố bề mặt diện tích tiếp xúc vì aluminium dạng bột có diện tích tiếp xúc lớn hơn nhiều so với aluminium dạng lá
d) Để thực phẩm trong tủ lạnh giúp cho thực phẩm được tươi lâu hơn. => Ảnh hưởng bởi yếu tố nhiệt độ do nhiệt độ trong tủ lạnh thấp hơn nhiệt độ bên ngoài môi trường nên làm cho các phản ứng phân hủy của vi khuẩn trong thực phẩm diễn ra chậm hơn, thực phẩm được tươi lâu hơn
e) Sử dụng nồi áp suất để hầm thức ăn giúp thức ăn nhanh chín. => Ảnh hưởng bởi yếu tố nhiệt độ vì khi tăng áp suất, nhiệt độ sôi của nước tăng làm cho thực phẩm nhanh chín hơn
g) Sử dụng các loại men thích hợp để làm sữa chua, lên men rượu, giấm,… => Ảnh hưởng bởi yếu tố chất xúc tác vì các loại men làm cho phản ứng dễ xảy ra hơn
16.12
Chè (trà) xanh là thực phẩm được dùng phổ biến để nấu nước uống, có tác dụng chống lão hoá, giảm nguy cơ bị ung thư, phòng một số bệnh về tim mạch và giảm cân,… Tuy nhiên, uống nhiều nước chè xanh hay nước chè đặc sẽ gây thiếu hụt hồng cầu trong máu, đau dạ dày, xót ruột, buồn nôn. Caffeine là chất kích thích cũng có nhiều trong lá chè, làm thần kinh căng thẳng, mất ngủ, suy giảm trí nhớ và dễ gây nghiện.
Hãy làm rõ yếu tố nồng độ các chất có trong lá chè xanh, caffeine ảnh hưởng đến sức khoẻ con người trong khuyến cáo trên.

Dựa vào nồng độ của caffeine có trong nước chè loãng và nước chè đặc để giải thích

- Trong 1 lượng chè, lượng caffeine sẽ không thay đổi. Vì vậy nếu cho nhiều chè và ít nước (để pha nước chè đặc) thì lượng caffeine sẽ nhiều hơn so với lượng caffeine có trong nước chè loãng
- Khi ở nồng độ cao, caffeine làm thần kinh căng thẳng, mất ngủ, suy giảm trí nhớ và dễ gây nghiện
16.13
Bộ chuyển đổi xúc tác là thiết bị được sử dụng để giảm lượng khí thải từ động cơ đốt trong của ô tô và các loại phương tiện giao thông hiện đại.
Thiết bị có sử dụng các kim loại platinum, rhodium và palladium để thúc đẩy quá trình nhường, nhận electron của chất trong khí thải, nó hoạt động theo cơ chế phản ứng oxi hoá – khử, chuyển đổi khoảng 98% khí thải độc hại thành khi ít độc hại hoặc không độc hại cho môi trường. Khí thải chứa các hydrocarbon bị oxi hoá thành carbon dioxide và nước, carbon monoxide thành carbon dioxide, các oxide của nitrogen bị khử thành nitrogen và oxygen giải phóng ra môi trường.
Thiết bị trên vận dụng yếu tố nào để tác động đến phản ứng?
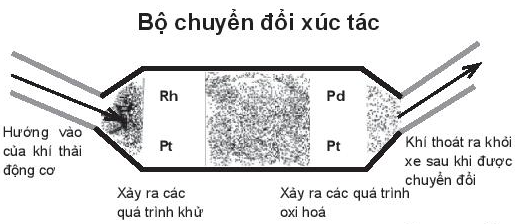

Dựa vào yếu tố chất xúc tác để giải thích

- Ta có các phương trình phản ứng:
+ Oxi hóa hydrocarbon: 4CxHy + (4x+y)O2 -> 4xCO2 + 2yH2O
+ Oxi hóa carbon monoxide: 2CO + O2 -> 2CO2
+ Quá trình khử các oxide của nitrogen: 2NxOy -> xN2 + yO2
- Như vậy có thể thấy, các kim loại platinum, rhodium và palladium chỉ thúc đẩy quá trình nhường, nhận electron của chất trong khí thải chứ không tham gia vào phản ứng ” Thiết bị trên vận dụng yếu tố chất xúc tác để tác động đến phản ứng
16.14
Năm 1785, một vụ nổ xảy ra tại nhà kho nhà Giacomelli (Roma, Italia) làm nghề nghiền bột mì. Sau khi điều tra, nguyên nhân ban đầu dẫn đến vụ nổ là do bột mì khô. Sự cố xảy ra khi bột mì bay trong không khí, chạm tới nguồn lửa của chiếc đèn, đây là vụ nổ bụi đầu tiên trong lịch sử. Sau đó là các vụ nổ bụi trong hầm than, xưởng sản xuất sữa bột, dược phẩm, nhựa, kim loại,... có tác nhân tương tự gồm: nguồn oxygen, nguồn nhiệt, bụi có thể cháy được, nồng độ bụi để đạt được vụ nổ và không gian đủ kín.
Thí nghiệm như bên cho thấy, bột mì không dễ cháy.
Tại sao bột mì và một số loại bụi khác có thể gây ra nổ bụi? Để ngăn ngừa và hạn chế nổ bụi, có thể can thiệp vào những tác nhân nào?


Dựa vào yếu tố diện tích bề mặt tiếp xúc để giải thích

- Do khi ở dạng bột hay dạng bụi => diện tích tiếp xúc sẽ rất lớn khiến cho phản ứng xảy ra nhanh hơn và sẽ gây nổ nếu đủ các tác nhân khác như nguồn oxygen, nguồn nhiệt, bụi có thể cháy được, nồng độ bụi để đạt được vụ nổ và không gian đủ kín
- Để ngăn ngừa và hạn chế nổ bụi, ta có thể can thiệp và các tác nhân:
+ Nồng độ hạt bụi: vệ sinh sạch sẽ trước và sau khi làm việc,…
+ Nguồn nhiệt: tắt điện trước khi ra về, kiểm tra hệ thống điện thường xuyên, bảo dưỡng định kì,…
16.15
Hệ thống phun nhiên liệu điện tử (Electronic Fuel Injection – EFI) được sử dụng trong động cơ ô tô, xe máy giúp tiết kiệm nhiên liệu, xe vận hành êm và giảm ô nhiễm môi trường. Hệ thống sử dụng bộ điều khiển điện tử để can thiệp vào bước phun nhiên liệu vào buồng đốt, nhiên liệu được phun giọt cực nhỏ (1); hệ thống điều chỉnh chính xác tỉ lệ nhiên liệu – không khí trước khi phun vào buồng đốt, một cách đồng đều, nhiên liệu được đốt cháy hoàn toàn (2). Khi phương tiện thay đổi vận tốc (tăng hoặc giảm), hệ thống sẽ nhanh chóng thay đổi lượng nhiên liệu – không khí phù hợp để phun vào buồng đốt (3), nên tiết kiệm nhiên liệu và giảm lượng khí thải gây ô nhiễm môi trường. Các ý (1), (2), (3) vận dụng yếu tố chính nào ảnh hưởng đến tốc độ phản ứng?

Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng để giải thích
(1) Diện tích bề mặt tiếp xúc
(2) Nồng độ
(3) Nồng độ

- Ý (1) vận dụng yếu tố diện tích bề mặt tiếp xúc vì nhiên liệu được phun dưới dạng giọt cực nhỏ
- Ý (2) vận dụng yếu tố nồng độ vì tỉ lệ nhiên liệu – không khí trước khi phun vào buồng đốt, một cách đồng đều giúp nhiên liệu được đốt cháy hoàn toàn
- Ý (3) vận dụng yếu tố nồng độ vì lượng nhiên liệu – không khí sẽ được thay đổi phù hợp để phun vào buồng đốt
16.16
Aspirin (acetylsalicylic acid, C9H8O4) là thuốc hạ sốt, giảm đau, có tính kháng viêm, được sử dụng khá phổ biến trên thế giới, khoảng 25000 tấn mỗi năm. Khi uống aspirin, phản ứng thuỷ phân xảy ra như sau:
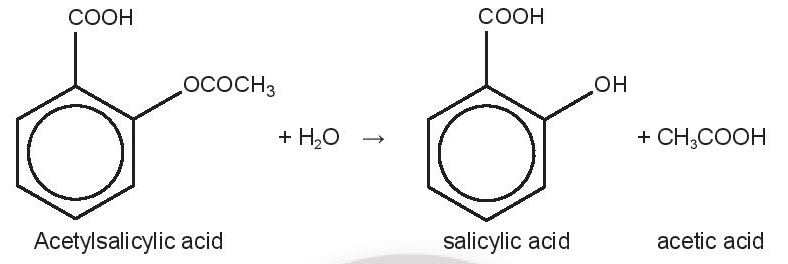
Salicylic acid là thành phần chính có tác dụng hạ sốt, giảm đau và viêm nhiễm, nên có nhiều nghiên cứu tập trung vào phản ứng thuỷ phân này và các yếu tố ảnh hưởng đến tốc độ phản ứng. Dữ liệu về quá trình thuỷ phân của một mẫu aspirin trong nước (môi trường trung tính) ở 37°C thể hiện trong bảng:
|
Thời gian (h) |
Nồng độ aspirin (M) |
Nồng độ salicylic acid (M) |
|
0 |
5,55.10-3 |
0 |
|
2 |
5,51.10-3 |
0,040.10-3 |
|
5 |
5,45.10-3 |
0,10.10-3 |
|
10 |
5,35.10-3 |
0,20.10-3 |
|
20 |
5,15.10-3 |
0,40.10-3 |
|
30 |
4,96.10-3 |
0,59.10-3 |
|
40 |
4,78.10-3 |
0,77.10-3 |
|
50 |
4,61.10-3 |
0,94.10-3 |
|
100 |
3,83.10-3 |
1,72.10-3 |
|
200 |
2,64.10-3 |
2,91.10-3 |
|
300 |
1,82.10-3 |
3,73.10-3 |
(*) Ở điều kiện này, phản ứng xảy ra rất chậm, trong môi trường acid, như điều kiện trong dạ dày, phản ứng xảy ra nhanh hơn.
a) Tính tốc độ trung bình của phản ứng thuỷ phân aspirin sau thời gian 2, 5, 10,..., 300 giờ.
b) Nhận xét sự thay đổi tốc độ phản ứng theo thời gian. Giải thích.
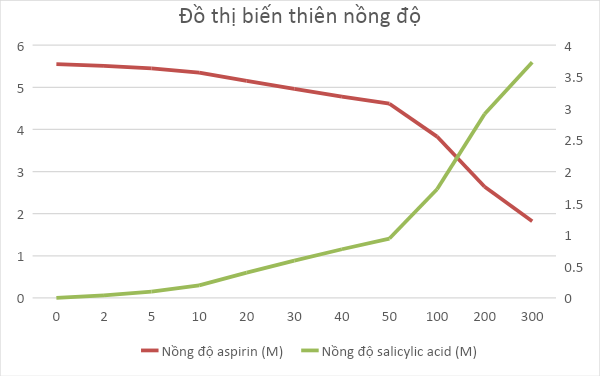
c) Vẽ đồ thị biểu diễn sự biến thiên nồng độ chất tham gia và sản phẩm theo thời gian của phản ứng trên.

aA + bB -> cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\)
+ \(\overline v \): tốc độ trung bình của phản ứng
+ \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ
+ \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian

a) Tốc độ của phản ứng thủy phân aspirin theo thời gian:
+ Từ 0h đến 2h: \(\overline v = - \frac{1}{1}.\frac{{5,{{51.10}^{ - 3}} - 5,{{55.10}^{ - 3}}}}{{2 - 0}} = {2.10^{ - 5}}\)
+ Từ 2h đến 5h: \(\overline v = - \frac{1}{1}.\frac{{5,{{45.10}^{ - 3}} - 5,{{51.10}^{ - 3}}}}{{5 - 2}} = {2.10^{ - 5}}\)
…
+ Tương tự ta sẽ có bảng kết quả như sau:
|
Thời gian (h) |
Nồng độ aspirin (M) |
Nồng độ salicylic acid (M) |
Tốc độ phản ứng (M/h) |
|
0 |
5,55.10-3 |
0 |
0 |
|
2 |
5,51.10-3 |
0,040.10-3 |
2.10-5 |
|
5 |
5,45.10-3 |
0,10.10-3 |
2.10-5 |
|
10 |
5,35.10-3 |
0,20.10-3 |
2.10-5 |
|
20 |
5,15.10-3 |
0,40.10-3 |
2.10-5 |
|
30 |
4,96.10-3 |
0,59.10-3 |
1,9.10-5 |
|
40 |
4,78.10-3 |
0,77.10-3 |
1,8.10-5 |
|
50 |
4,61.10-3 |
0,94.10-3 |
1,7.10-5 |
|
100 |
3,83.10-3 |
1,72.10-3 |
1,56.10-5 |
|
200 |
2,64.10-3 |
2,91.10-3 |
1,19.10-5 |
|
300 |
1,82.10-3 |
3,73.10-3 |
8,2.10-6 |
b) Trong 20 giờ đầu tiên, tốc độ phản ứng không đổi do nồng độ aspirin đủ lớn để duy trì tốc độ đó. Sau 20 giờ đầu tiên đó, nồng độ aspirin không đủ lớn khiến cho tốc độ phản ứng giảm dần theo thời gian
c) Đồ thị biểu diễn sự biến thiên của nồng độ chất tham gia và sản phẩm theo thời gian:
16.17
Hoạt động trong phòng thí nghiệm
- Chuẩn bị
+ Dụng cụ: Cân phân tích, cốc thuỷ tinh, đồng hồ bấm giây.
+ Hoá chất: CaCO3 dạng khối, dung dịch HCl 2 M.
- Tiến hành
+ Bước 1: Cân 5 – 7 viên đá vôi, ghi giá trị m1
+ Bước 2: Rót 100 ml dung dịch HCl vào cốc thuỷ tinh, cân khối lượng cốc, ghi giá trị m2
+ Bước 3: Để yên cốc trên giá cân. Cho các viên đá vôi vào cốc dung dịch HCl. Ghi nhận tổng khối lượng hiển thị trên cân sau mỗi 30 giây, thực hiện trong 10 phút
- Yêu cầu
1. Vận dụng định luật bảo toàn khối lượng, tính khối lượng khí CO2 sau mỗi 30 giây.
2. Tính tốc độ trung bình của phản ứng sau khoảng thời gian 1, 2, 3, 4 phút
3. Nhận xét tốc độ phản ứng thay đổi thế nào theo thời gian. Giải thích.
4. Vẽ biểu đồ biểu diễn khối lượng CO2 trong các thời điểm khác nhau

1. Định luật bảo toàn khối lượng: Khối lượng các chất tham gia phản ứng và khối lượng các chất tạo thành sau phản ứng phải bằng nhau
2. Biểu thức tốc độ trung bình của phản ứng:
aA + bB -> cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\)
+ \(\overline v \): tốc độ trung bình của phản ứng
+ \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ
+ \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian
3. Tốc độ phản ứng sẽ giảm dần theo thời gian vì nồng độ các chất giảm dần theo thời gian ” Số lượng va chạm hiệu quả giảm -> Tốc độ phản ứng giảm dần
