6.1
Phản ứng 2NO(g) + O2(g) → 2NO2(g) có biểu thức tốc độ tức thời: v= \(k.C_{NO}^2.{C_{{O_2}}}\). Nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì tốc độ sẽ
A. giảm 2 lần.
B. giảm 4 lần.
C. giảm 3 lần.
D. giữ nguyên.

Dựa vào biểu thức tốc độ tức thời của phản ứng
aA + bB -> cC + dD là \(v = k.C_A^a.C_B^b\)

- Dựa theo biểu thức tốc độ tức thời ta có: \(v = k.C_{NO}^2.C_{{O_2}}^1\)
- Khi nồng độ NO giảm 2 lần ta có: \(v’ = k.{(\frac{{C_{NO}^{}}}{2})^2}.C_{{H_2}O}^1\) ” \(v’ = \frac{v}{4}\)
=> Tốc độ phản ứng giảm 4 lần
=> Đáp án: B
6.2
Nếu mỗi đồ thị có các chất phản ứng cùng nồng độ và trục thời gian thì tốc độ của chất phản ứng nào xảy ra nhanh nhất?
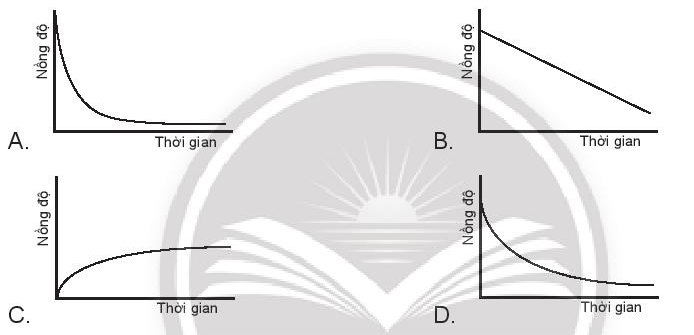

Dựa vào độ cong của đồ thị, đồ thị nào có độ cong càng sâu chứng tỏ trong thời gian ngắn, nồng độ chất tham gia giảm nhanh

- Đáp án: A
6.3
Thanh phát sáng là một sản phẩm quen thuộc được dùng giải trí. Đặt 2 thanh phát quang hóa học vào 2 cốc nước nóng (trái) và lạnh (phải) như hình bên, yếu tố ảnh hưởng đến độ phát sáng của 2 thanh là
A. nồng độ.
B. chất xúc tác.
C. bề mặt tiếp xúc.
D. nhiệt độ.
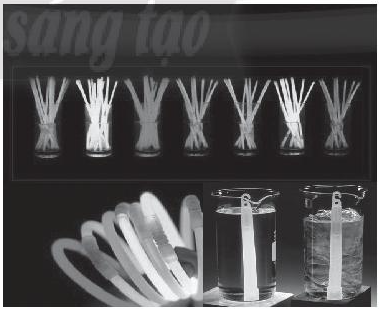

- Đáp án: D
6.4
Trong hầu hết các phản ứng hoá học, tốc độ phản ứng tăng khi nhiệt độ tăng. Muốn pha một cốc trà đá có đường, bằng cách thêm đá viên và đường vào cốc trà nóng, thứ tự nào sẽ được cho vào trước?

- Vì đường tan tốt hơn trong nước nóng nên sẽ cho đường vào trước rồi cho đá viên vào cốc trà nóng sau
6.5
Cho phương trình hoá học của phản ứng: 2CO(g) + O2(g) → 2CO2(g). Với biểu thức tốc độ tức thời là \(v = k.C_{CO}^2.{C_{{O_2}}}\), khi nồng độ mol của CO là 1 M và O2 là 1 M, tính giá trị v và nêu ý nghĩa của k.

Dựa vào biểu thức tốc độ tức thời là \(v = k.C_{CO}^2.{C_{{O_2}}}\)

- Khi nồng độ mol của CO là 1 M và O2 là 1 M thì \(v = k.C_{CO}^2.{C_{{O_2}}} = k{.1^2}.1 = k\)
- Ý nghĩa của k:
+ Trong các biểu thức tính tốc độ tức thời: k là hằng số tốc độ phản ứng
+ Trong phản ứng 2CO(g) + O2(g) → 2CO2(g) thì k là tốc độ riêng của phản ứng này
6.6
Từ thí nghiệm ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng trong SGK trang 101, 102, nếu ở bình (2), sau thời gian 60 giây, thể tích khí CO2 thu được là 30 mL. Tính tốc độ trung bình (mL/s) của phản ứng trong 60 giây.

Dựa vào biểu thức tốc độ trung bình của phản ứng: \(\overline v = \frac{V}{{\Delta t}}\)
+ \(\overline v \): tốc độ trung bình của phản ứng (mL/s)
+ \(V\): thể tích của khí (mL)
+ \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian (s)

- Tốc độ trung bình (mL/s) của phản ứng là: \(\overline v = \frac{{30}}{{60}} = 0,5\) (mL/s)
6.7
Trong phản ứng. A → sản phẩm
Tại thời điểm t = 0, nồng độ chất A là 0,1563 M, sau 1 phút, nồng độ chất A là 0,1496 M và sau 2 phút, nồng độ chất A là 0,1431 M.
a) Tính tốc độ trung bình của phản ứng trong phút thứ nhất và trong phút thứ 2.
b) Nhận xét tốc độ phản ứng trong phút thứ nhất và phút thứ 2. Giải thích.

Dựa vào biểu thức tốc độ trung bình của phản ứng:
aA + bB ” cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\)
+ \(\overline v \): tốc độ trung bình của phản ứng
+ \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ
+ \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian

a) - Tốc độ trung bình của phản ứng trong phút thứ nhất là:
\(\overline v = - \frac{1}{1}.\frac{{0,1431 - 0,1496}}{{60}} = 1,{08.10^{ - 4}}\) (M/s)
- Tốc độ trung bình của phản ứng trong phút thứ hai là:
\(\overline v = - \frac{1}{1}.\frac{{0,1496 - 0,1563}}{{60}} = 1,{12.10^{ - 4}}\) (M/s)
b) Tốc độ trung bình của phản ứng trong phút thứ hai thấp hơn phút thứ nhất vì nồng độ chất A giảm dần theo thời gian => Số va chạm hiệu quả giảm => Tốc độ phản ứng giảm
6.8
Xét phản ứng phân huỷ N2O5 theo phương trình hoá học:
2N2O5(g) → 4NO2(g) + O2(g), xảy ra ở 56°C cho kết quả theo bảng:
|
Thời gian (s) |
N2O5(M) |
NO2(M) |
O2(M) |
|
240 |
0,0388 |
0,0315 |
0,0079 |
|
Advertisements (Quảng cáo) 600 |
0,0196 |
0,0699 |
0,0175 |
Tính tốc độ trung bình của phản ứng trong khoảng thời gian trên.

aA + bB -> cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\)
+ \(\overline v \): tốc độ trung bình của phản ứng
+ \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ
+ \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian

- Tốc độ trung bình của phản ứng là
\(\overline v = - \frac{1}{2}.\frac{{\Delta {C_{{N_2}{O_5}}}}}{{\Delta t}} = \frac{1}{1}.\frac{{\Delta {C_{{O_2}}}}}{{\Delta t}} = \frac{1}{4}.\frac{{\Delta {C_{N{O_2}}}}}{{\Delta t}}\)
=> \(\overline v = - \frac{1}{2}.\frac{{0,0196 - 0,0388}}{{600 - 240}} = \frac{1}{4}.\frac{{0,0175 - 0,0079}}{{600 - 240}} = \frac{1}{1}.\frac{{0,0699 - 0,0315}}{{600 - 240}} = 2,{667.10^{ - 5}}\) (M/s)
6.9
Sự phân huỷ H2O2, theo phương trình hoá học: 2H2O2(aq) → 2H2O(l) + O2(g), được nghiên cứu và cho kết quả tại một nhiệt độ cụ thể như sau:
|
Thời gian (s) |
H2O2 (mol/L) |
|
0 |
1,000 |
|
120 |
0,910 |
|
300 |
0,780 |
|
600 |
0,590 |
|
1200 |
0,370 |
|
1800 |
0,220 |
|
2400 |
0,130 |
|
3000 |
0,082 |
|
3600 |
0,050 |
a) Tính tốc độ trung bình của phản ứng phân huỷ H2O2 theo thời gian.
b) Tốc độ phản ứng thay đổi thế nào theo thời gian? Giải thích sự thay đổi đó.

aA + bB -> cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\)
+ \(\overline v \): tốc độ trung bình của phản ứng
+ \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ
+ \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian

a) Tốc độ của phản ứng thủy phân H2O2 theo thời gian:
+ Từ 0s đến 120s: \(\overline v = - \frac{1}{2}.\frac{{0,910 - 1,000}}{{120 - 0}} = 3,{75.10^{ - 4}}\)
+ Từ 120s đến 300s: \(\overline v = - \frac{1}{2}.\frac{{0,780 - 0,910}}{{300 - 120}} = 3,{61.10^{ - 4}}\)
…
+ Tương tự ta sẽ có bảng kết quả như sau:
|
Thời gian (s) |
H2O2 (mol/L) |
Tốc độ phản ứng (mol/L.s) |
|
0 |
1,000 |
0 |
|
120 |
0,910 |
3,75.10-4 |
|
300 |
0,780 |
3,61.10-4 |
|
600 |
0,590 |
3,17.10-4 |
|
1200 |
0,370 |
1,83.10-4 |
|
1800 |
0,220 |
1,25.10-4 |
|
2400 |
0,130 |
7,5.10-5 |
|
3000 |
0,082 |
4.10-5 |
|
3600 |
0,050 |
2,67.10-5 |
b) Tốc độ phản ứng giảm dần theo thời gian. Vì nồng độ H2O2 giảm dần ” Số va chạm hiệu quả giảm => Tốc độ phản ứng giảm
