Dựa vào cấu tạo, hãy giải thích vì sao tính oxi hoá của ion hipoclorit \(ClO^-\) mạnh hơn ion clorat \(ClO_3^-\). Lấy thí dụ phản ứng để minh hoạ.

\(ClO^-\) và \(ClO_3^-\) có cấu tạo tương ứng như sau :
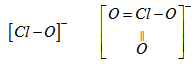
Advertisements (Quảng cáo)
Liên kết Cl-O trong \(ClO_3^-\) ngắn hơn trong \(ClO^-\) nên độ bền \(ClO_3^-\) > \(ClO^-\). Do đó tính oxi hoá \(ClO_3^-\) < \(ClO^-\).
Trong dung dịch nước, ion \(ClO_3^-\) chỉ oxi hoá trong môi trường axit mạnh, còn ion \(ClO^-\) oxi hoá trong bất kì môi trường nào.
Thí dụ : \(NaClO + 2KI + H_2O → NaCl + I_2 + 2KOH\)
\(NaClO_3 + 6KI + 3H_2SO_4 → NaCl + 3I_2 + 3K_2SO_4 + 3H_2O\)
