Câu hỏi/bài tập:
Hỗn hợp (X) gồm Mg và Fe2O3 có khối lượng 20 gam tan hết trong dung dịch H2SO4 loãng thoát ra a L khí H2 (đkc) và tạo thành dung dịch (Y). Thêm dung dịch NaOH dư vào dung dịch (Y) và lọc kết tủa, tách ra nung đến khối lượng không đổi thu được 28 gam chất rắn. Phần trăm khối lượng Mg trong hỗn hợp (X) là
A. 40%. B. 60%. C. 25%. D. 75%.

Tính số mol oxygen tạo oxide với magnesium, từ đó tính số mol của Mg rồi tính phần trăm khối lượng Mg trong hỗn hợp (X).

Advertisements (Quảng cáo)
Sơ đồ phản ứng:
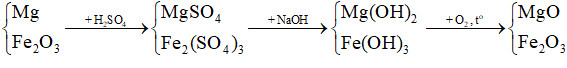
Ta thấy khối lượng ban đầu (Mg và Fe2O3) và khối lượng chất rắn không đổi (MgO, Fe2O3) chênh lệch nhau ở khối lượng của nguyên tố oxygen.
\[\begin{array}{l} \Rightarrow {\rm{ }}{{\rm{m}}_{{\rm{O/MgO}}}} = {\rm{ }}28 - {\rm{ }}20{\rm{ }} = {\rm{ }}8{\rm{ }}\left( {\rm{g}} \right)\\ \Rightarrow {{\rm{n}}_{\rm{O}}}{\rm{ = }}\frac{{\rm{8}}}{{{\rm{16}}}}{\rm{ = 0,5 (mol)}}\end{array}\]
Bảo toàn nguyên tố O, ta có: nMg = nO = 0,5 (mol)
\[\begin{array}{l} \Rightarrow {{\rm{m}}_{{\rm{Mg}}}} = 0,5 \times 24 = 12{\rm{ }}({\rm{g}})\\ \Rightarrow \% {{\rm{m}}_{{\rm{Mg}}}} = \frac{{12}}{{20}} \times 100\% = 60\% \end{array}\]
