Câu hỏi/bài tập:
Đốt cháy 20,63 mg hợp chất Y, chỉ chứa C, H và O, bằng lượng dư khí oxygen tạo 57,94 mg CO2 và 11,85 mg H2O.
a) Tính khối lượng (theo mg) của C, H và O trong hợp chất Y.
b) Xác định công thức thực nghiệm của Y.
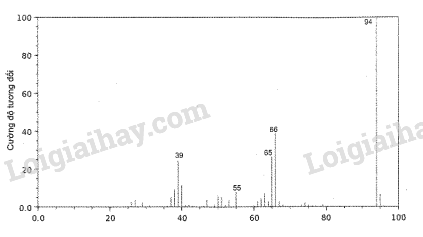
c) Dựa trên phổ khối lượng của Y như hình cho dưới đây, xác định công thức phân tử của Y.

Một hợp chất hữu cơ có công thức phân tử là CxHyOz. Thiết lập công thức đơn giản nhất bằng cách lập tỉ lệ x : y : z ở dạng số nguyên tối giản p : q : r.
Lập tỉ lệ mol của các nguyên tố \({\rm{x}}:{\mathop{\rm y}\nolimits} :{\rm{z}} = {{\rm{n}}_{\rm{C}}}:{{\rm{n}}_{\rm{H}}}:{{\rm{n}}_{\rm{O}}} = {\rm{p}}:{\rm{q}}:{\rm{r}}\)
Từ đó thiết lập được công thức đơn giản nhất: CpHqOr.
Mối quan hệ giữa công thức phân tử và công thức đơn giản nhất:CxHyOz = (CpHqOr)n
Trong đó: p, q, r là các số nguyên tối giản; x, y, z, n là các số nguyên dương.
Advertisements (Quảng cáo)
Khi biết phân tử khối, xác định được giá trị n, từ đó suy ra công thức phân tử.

a) Bảo toàn nguyên tố C: \({{\rm{n}}_{\rm{C}}} = {{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}} \Rightarrow {{\rm{m}}_{\rm{C}}} = \frac{{57,94}}{{44}} \times 12 \approx 15,81{\rm{ (mg)}}\)
Bảo toàn nguyên tố H: \({{\rm{n}}_{\rm{H}}} = 2{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}} \Rightarrow {{\rm{m}}_{\rm{H}}} = 2 \times \frac{{11,85}}{{18}} \times 1 \approx 1,317{\rm{ (mg)}}\)
\( \Rightarrow {{\rm{m}}_{\rm{O}}} = {{\rm{m}}_{\rm{Y}}} - ({{\rm{m}}_{\rm{C}}} + {{\rm{m}}_{\rm{H}}}) = 20,63 - (15,81 + 1,317) = 3,503{\rm{ (mg)}}\)
b) Ta có tỉ lệ mol của các nguyên tố:
\(\frac{{15,81}}{{12}}:\frac{{1,371}}{1}:\frac{{3,503}}{{16}} = 1,318:1,371:0,219 = 6:6:1\)
Vậy công thức thực nghiệm của Y là C6H6O.
c) Từ phổ khối lượng của Y, ta có: \({{\rm{M}}_{\rm{Y}}} = 94\)
\(\begin{array}{l} \Leftrightarrow {{\rm{M}}_{{{\left( {{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{6}}}{\rm{O}}} \right)}_{\rm{n}}}}} = 94\\ \Leftrightarrow (12 \times 6 + 1 \times 6 + 16) \times {\rm{n}} = 94\\ \Rightarrow {\rm{n}} = \frac{{94}}{{94}} = 1\end{array}\)
Vậy công thức phân tử của Y là C6H6O.
