Câu hỏi/bài tập:
Hiện nay, mưa acid, hiệu ứng nhà kính và thủng tầng ozone là ba thảm họa môi trường toàn cầu. Mưa acid tàn phá nhiều rừng cây, các công trình kiến trúc bằng đá và kim loại. Tác nhân chủ yếu gây ra mưa acid là sulfur dioxide.
a) Trong khí quyển, SO2 chuyển hoá thành H2SO4 trong nước mưa theo sơ đồ sau:
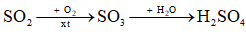
Viết các phương trình hoá học.
b) Một cơn mưa acid xuất hiện tại một khu công nghiệp diện tích 10 km2 với lượng mưa trung bình 80 mm. Hãy tính:
- Thể tích nước mưa đã rơi xuống khu công nghiệp.
- Khối lượng H2SO4 trong lượng nước mưa, biết nồng độ H2SO4 trong nước mưa là 2.10-5 M.
c) Lượng acid trong nước mưa có thể ăn mòn các công trình bằng đá vôi.
- Viết 1 phương trình hoá học minh hoạ.
- Khối lượng CaCO3 tối đa bị ăn mòn bởi lượng acid trên.
d) Em hãy tìm hiểu về nguyên nhân phát sinh các khí gây mưa acid và đề xuất giải pháp hạn chế.

Advertisements (Quảng cáo)
a) \({\rm{2S}}{{\rm{O}}_2} + {\rm{ }}{{\rm{O}}_2} \to 2{\rm{S}}{{\rm{O}}_3}{\rm{ }}\)
\({\rm{S}}{{\rm{O}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }}\)
b) Thể tích nước mưa chứa H2SO4 tại khu công nghiệp diện tích 10 km2: \({\rm{V}} = 10 \times {1000^2} \times \frac{{80}}{{1000}} = 8 \times {10^5}{\rm{ (}}{{\rm{m}}^3})\)
Số mol của H2SO4 trong lượng nước mưa: \({{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} = 8 \times {10^5} \times {10^3} \times 2 \times {10^{ - 5}} = 16 \times {10^3}{\rm{ }}({\rm{mol)}}\)
Khối lượng H2SO4 trong lượng nước mưa: \({{\rm{m}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} = 16 \times {10^3} \times 98 = 1568 \times {10^3}({\rm{g) = }}1568{\rm{ }}({\rm{kg) }}\)
c) \({\rm{CaC}}{{\rm{O}}_{\rm{3}}} + {\rm{ }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{CaS}}{{\rm{O}}_{\rm{4}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} + {\rm{C}}{{\rm{O}}_{\rm{2}}}\)
\(\begin{array}{l}{{\rm{n}}_{{\rm{CaC}}{{\rm{O}}_{\rm{3}}}}}{\rm{ = }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} = 16 \times {10^3}{\rm{ }}({\rm{mol)}}\\ \Rightarrow {{\rm{m}}_{{\rm{CaC}}{{\rm{O}}_{\rm{3}}}}} = 16 \times {10^3} \times 100 = 16 \times {10^5}{\rm{(g) = 1600 (kg)}}\end{array}\)
d) - Nguyên nhân phát sinh các khí gây mưa acid:
+ Nguồn phát sinh sulfur dioxide
Sulfur dioxide được sinh ra từ cả nguồn tự nhiên (khí thải núi lửa) và nguồn nhân tạo. Nguồn sulfur dioxide nhân tạo chủ yếu sinh ra từ quá trình đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide (galen, blend) trong luyện kim, đốt sulfur và quặng pyrite trong sản xuất sulfuric acid,....
+ Nguồn gốc phát sinh NOx trong không khí
Bên cạnh nguồn gốc tự nhiên như núi lửa phun trào, cháy rừng, mưa dông kèm theo sấm sét, sự phân huỷ các hợp chất hữu cơ, thì sự phát sinh NOx chủ yếu là do hoạt động của con người. Các nguồn gây phát thải NOx nhân tạo từ hoạt động giao thông vận tải, sản xuất công nghiệp, nông nghiệp, nhà máy nhiệt điện và trong đời sống.
- Giải pháp hạn chế phát sinh NOx, SO2: tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo; sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên; cải tiến công nghệ sản xuất, có biện pháp xử lý khí thải và tái chế các sản phẩm phụ có chứa sulfur, nitrogen
