2.11. Cho lượng khí amoniac đi từ từ qua ống sứ chứa 3,2 g CuO nung nóng đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn A và một hỗn hợp khí. Chất rắn A phản ứng vừa đủ với 20 ml dung dịch HCl 1M.
1. Viết phương trình hoá học của các phản ứng.
2. Tính thể tích khí nitơ (đktc) được tạo thành sau phản ứng.

1. Phương trình hoá học của các phản ứng :
\(2N{H_3} + 3CuO\) 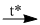 \({N_2} + 3Cu + 3{H_2}O\) (1)
\({N_2} + 3Cu + 3{H_2}O\) (1)
Chất rắn A thu được sau phản ứng gồm Cu và CuO còn dư. Chỉ có CuO phản ứng với dung dịch HCl :
Advertisements (Quảng cáo)
CuO + 2HCl \( \to \) CuCl2 + H2O (2)
2. Số mol HCl phản ứng với CuO : nHCl = 0,02.1 = 0,02 (mol).
Theo (2), số mol CuO dư : nCuO = \(\frac{1}{2}\)số mol HCl = \(\frac{0,02}{2}\) = 0,01 (mol).
Số mol CuO tham gia phản ứng (1) = số mol CuO ban đầu - số mol CuO dư = \(\frac{{3,2}}{{80}} - 0,01\) = 0,03 (mol).
Theo (1), số mol NH3 = \(\frac{2}{3}\)số mol CuO = \(\frac{2}{3}\).0,03 = 0,02 (mol) và số mol N2 = \(\frac{1}{3}\)số mol CuO = \(\frac{1}{3}\).0,03 = 0,01 (mol).
Thể tích khí nitơ tạo thành : 0,01.22,4 = 0,224 (lít) hay 224 ml.
