Câu hỏi trang 81 Mở đầu
Cho các hydrocarbon sau: ethane (CH3 - CH3), ethene (CH2 = CH2) và ethyne (CH ≡ CH). Trong các chất trên, chất nào là hydrocarbon no, chất nào là hydrocarbon không no?

Hydrocarbon no là hydrocarbon mà trong phân tử chỉ có liên kết đơn.
Hydrocarbon không no là hydrocarbon trong phân tử có liên kết đối (C = C) hoặc liên kết ba (C ≡ C) (gọi chung là liên kết bội) hoặc cả hai loại liên kết đó. Ví dụ: các alkene, alkyne, alkadiene,...

Hydrocarbon no: ethane (CH3 - CH3).
Hydrocarbon không no: ethene (CH2 = CH2) và ethyne (CH ≡ CH).
Câu hỏi trang 82 Câu hỏi 1
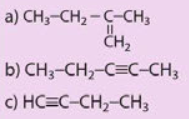
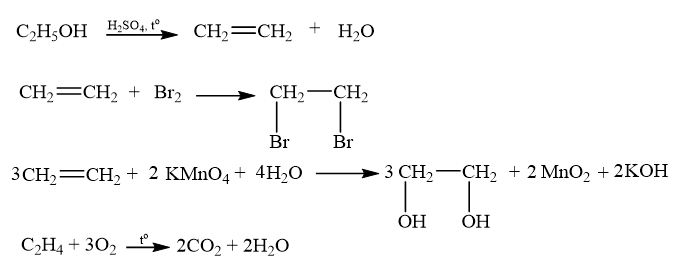
Cho công thức cấu tạo của các chất dưới đây:
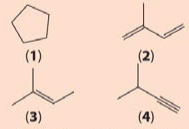
a) Viết công thức phân tửcủa các chất trên.
b) Cho biết trong cácchất trên, chất nào là hydrocarbon không no, chất nào là alkene, chất nào là alkyne.

Hydrocarbon không no là hydrocarbon trong phân tử có liên kết đối (C = C) hoặc liên kết ba (C ≡ C) (gọi chung là liên kết bội) hoặc cả hai loại liên kết đó. Ví dụ: các alkene, alkyne, alkadiene,...
Alkene là hydrocarbon không no, mạch hở, phân tử có một liên kết đôi (C = C), có công thức chung là C2H2n (n ≥ 2).
Alkyne là hydrocarbon không no, mạch hở, phân tử có một liên kết ba (C ≡ C), có công thức chung là C2H2n-2 (n ≥ 2).

a) (1) C5H10; (2) C5H8; (3) C5H10; (4) C5H8.
b) Hydrocarbon không no: (2), (3), (4).
Alkene: (2), (3).
Alkyne: (4).
Câu hỏi trang 82 Luyện tập
Từ Hình 13.1 và 13.2, hãymô tả dạng hình học của các phân tử ethene và ethyne.

Dạng hình học của phân tử là sự phân bố không gian của các nguyên tử xung quanh một nguyên tử trung tâm.

Dạng hình học của phân tử ethene: hai nguyên tử C mang liên kết đôi và 4 nguyên tử H đều nằm cùng trên một mặt phẳng phân tử.
Dạng hình học của phân tử ethyne: hai nguyên tử C mang liên kết ba và 2 nguyên tử H liên kết trực tiếp với chúng nằm trên cùng một đường thẳng.
Câu hỏi trang 82 Câu hỏi 2
Viết công thức cấu tạo của các alkene có công thức phân tử C4H8. Trong các chất này, những chất nào là đồng phân mạch carbon, những chất nào là đồng phân vị trí liên kết đôi của nhau?

Công thức cấu tạo biểu diễn thứ tự và cách thức liên kết (liên kết đơn, liên kết đôi, liên kết ba) giữa các nguyên tử trong phân tử.
Những hợp chất khác nhau nhưng có cùng công thức phân tử được gọi là các chất đồng phân của nhau.

Các đồng phân của alkene có công thức C4H8:
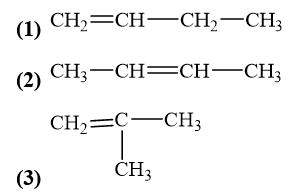
Đồng phân mạch carbon: (1), (3).
Đồng phân vị trí liên kết đôi: (1) và (2).
Câu hỏi trang 82 Câu hỏi 3
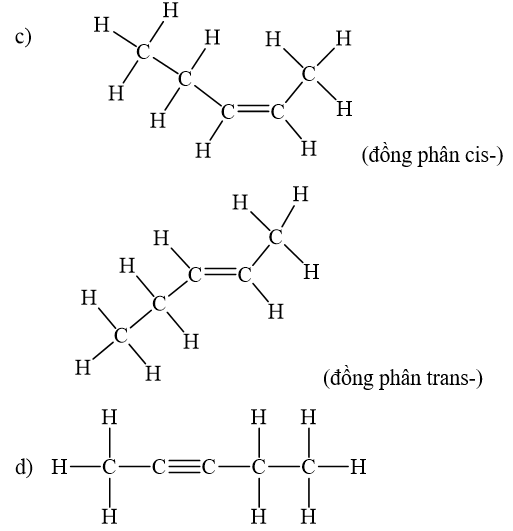
Viết công thức cấu tạo dạng đầy đủ và chỉ rõ đồng phân cis-, trans- (nếu có) của mỗi chất sau.
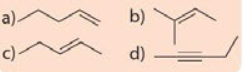

Công thức cấu tạo biểu diễn tất cả các nguyên tử và liên kết trong phân tử được gọi là công thức cấu tạo đầy đủ.
Alkene còn có đồng phân hình học khi mỗi nguyên tử carbon ở liên kết đối, liên kết với các nguyên tử nhóm nguyên tử khác nhau. Đồng phân cis- có mạch chính nằm về một phía của liên kết đôi, còn đồng phân trans- có mạch chính nằm về hai phía khác nhau của liên kết đôi.

Câu hỏi trang 83 Luyện tập 2
Gọi tên các chất có công thức cấu tạo sau:

Tên thay thế của alkene hay alkyne gồm hai phần: phần tiền tố cho biết số lượng nguyên tử carbon trong mạch carbon (eth-, prop-, but-,...), phần hậu tố (tương tự như -ane trong alkane) là -ene (đối với alkene) hay -yne (đối với alkyne).
Khi mạch carbon dài hơn, cần thêm số chỉ vị trí liên kết bội trong mạch carbon vào ngay phía trước hậu tố -ene (khi gọi tên alkene) hay -yne (khi gọi tên alkyne). Mạch carbon được đánh số từ phía gần liên kết bội hơn. Khi đó:
• Tên của alkene và alkyne mạch không phân nhánh được gọi như sau:
Tên tiền tố - số chỉ vị trí liên kết bội – tên hậu tố
• Tên của alkene, alkyne có mạch nhánh được gọi như sau:
Số chỉ vị trí nhánh – tên mạch nhánh + tên tiền tố (mạch chính) – số chỉ vị trí liên kết bội – tên hậu tố.

a) 2 – methylbut – 1 – ene.
b) pent – 2 – yne.
c) but – 1 – yne.
Câu hỏi trang 84 Vận dụng 1
Thêm hex-1-ene (khối lượng riêng D = 0,67 g.mL-1) vào mỗi ống nghiệm chứa nước (D = 1,00 g.mL-1) hoặc chloroform (CHCl3 có D = 1,49 g.mL-1) rồi lắc đều. Sau khi để yên vài phút, trường hợp nào xảy ra sự phân lớp và khi đó chất nào ở lớp trên, chất nào ở lớp dưới?

Alkene và alkyne là các chất kém phân cực, vì thế chúng hầu như không tan trong nước, nhưng tan tốt trong các dung môi hữu cơ như methanol, acetone, diethyl ether, chloroform,...

Hex – 1 – ene tan tốt trong chloroform, nhưng không tan tốt trong nước. Do đó:
+ Ống nghiệm chứa chloroform và hex – 1 – ene không bị phân lớp.
+ Ống nghiệm chứa nước và hex – 1 – ene bị phân lớp, hex – 1 – ene nhẹ hơn ở lớp trên, nước nặng hơn ở lớp dưới.
Câu hỏi trang 85 Câu hỏi 5
Năng lượng liên kết của liên kết C - C (trong phân tử ethane) là 368 kJ mol-1 và năng lượng liên kết của liên kết C = C (trong phân tử ethene) là 636 kJ mol-1. Hãy cho biết liên kết nào (\(\sigma \) hay \(\pi \)) dễ bị bẻ gãy hơn khi phân tử tham gia phản ứng.

Năng lượng liên kết càng lớn, liên kết càng dễ bị phá vỡ.
Liên kết đơn được tạo bởi liên kết \(\sigma \), liên kết đôi được tạp bởi liên kết \(\sigma \) và liên kết \(\pi \).

Liên kết đơn C – C có gồm 1 liên kết \(\sigma \) có năng lượng là 368 kJ mol-1.
Liên kết đôi C = C gồm 1 liên kết \(\sigma \) và liên kết \(\pi \) có năng lượng là 636 kJ mol-1.
=> Năng lượng của liên kết \(\pi \) là: 636 – 368 = 268 (kJ mol-1)
Vì năng lượng của liên kết \(\sigma \)(368 kJ mol-1) lớn hơn năng của liên kết \(\pi \)(268 kJ mol-1) nên khi phân tử tham gia phản ứng, liên kết \(\pi \) dễ bị bẻ gãy hơn.
Câu hỏi trang 85 Câu hỏi 6
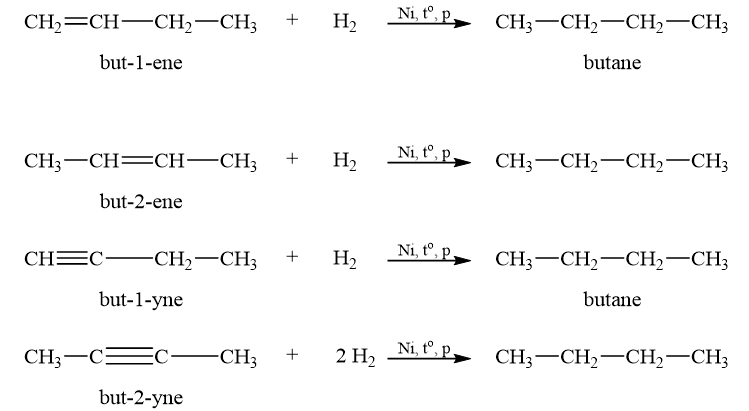
Cho biết công thức cấu tạo và tên gọi của alkene, alkyne mà khi hydrogen hoá tạo thành butane.

Alkene cộng hydrogen tạo thành alkane. Phản ứng xảy ra thuận lợi khi có mặt xúc tác (platinum, palladium hay nickel) và trong điều kiện đun nóng, ở áp suất cao.
Phản ứng cộng hydrogen vào alkyne với những xúc tác như platinum, palladium hay nickel chủ yếu tạo thành alkane mà không dừng lại ở giai đoạn tạo alkene.Để hydrogen hoá alkyne thành alkene, cần sử dụng xúc tác Lindlar.

Câu hỏi trang 86 Luyện tập 3
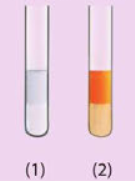
Dưới đây là hình ảnh các ống nghiệm chứa hexane và hex-1-ene sau khi được thêm nước bromine rồi lắc đều.
a) Trong mỗi ống nghiệm, nước nằm trong lớp chất lỏng ở phía trên hay phíadưới?
b) Ống nghiệm nào chứa hexane, ống nghiệm nào chứa hex-1-ene? Giải thích sự khác nhau về màu sắcgiữa hai ống nghiệm.

- Trong điều kiện thích hợp (được chiếu sáng hoặc đun nóng), alkane có thể phản ứng với halogen (chlorine, bromine). Khi đó, các nguyên tử hydrogen trong phân tử alkane dần bị thay thế bởi các nguyên tử halogen. Phản ứng xảy ra theo từng nấc để tạo thành lần lượt các dẫn xuất monohalogeno (chứa một nguyên tử halogen), dihalogeno (chứa hai nguyên tử halogen), trihalogeno (chứa ba nguyên tử halogen)....
- Alkyne cộng halogen theo từng bước: trước tiên tạo dihalogenoalkene không no, sau đó dihalogenoalkene tiếp tục cộng để tạo thành sản phẩm tetrahalogenoalkane. Alkene, alkyne làm mất màu vàng nâu của nước bromine Vì thế, nước bromine được sử dụng dễ nhận biết hydrocarbon không no.

a) Trong mỗi ống nghiệm, nước nằm trong lớp chất lỏng ở phía trên.
b) - Ống nghiệm 1 chứa hex – 1 – ene vì ở nhiệt độ thường, hex – 1 – ene phản ứng cộng với dung dịch bromine, làm mất màu nâu của dung dịch bromine.
- Ống nghiệm 2 chứa hexane vì ở nhiệt độ thường, hexane không phản ứng thế với dung dịch bromine ở nhiệt độ thường, nên hexane không làm mất màu nâu của dung dịch bromine.
Câu hỏi 87 Luyện tập 4
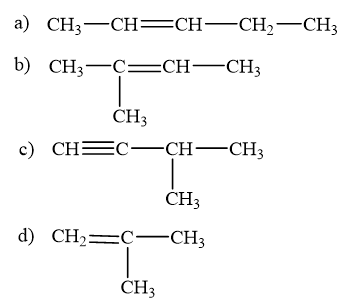
Viết phương trình hoá học và xác định sản phẩm chính trong mỗi phản ứng sau:
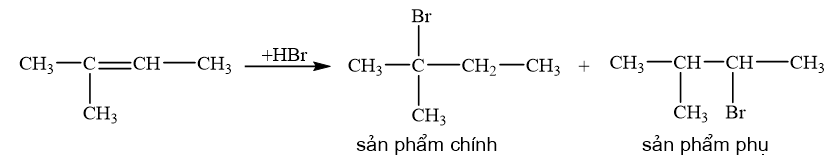
a) 2-methylbut-2-ene phȧn ứng với HBr.
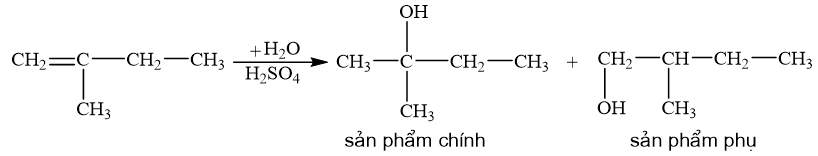
b) 2-methylbut-1-ene phản ứng với nước (xúc tác H2SO4).

Quy tắc Markovnikov: Trong phản ứng cộng HX vào hydrocarbon không no, nguyên tử H ưu tiên cộng vào nguyên tử carbon mang liên kết đôi có nhiều hydrogen hơn (bậc thấp hơn) còn nguyên tử X cộng vào nguyên tử carbon mang liên kết đôi chứa it hydrogen hơn (bậc cao hơn).

Câu hỏi trang 87 Câu hỏi 7
Viết phương trình hoá học của phản ứng trùng hợp propene.

Ở điều kiện nhiệt độ, xúc tác và áp suất thích hợp, các phân tử alkene có thể tham gia phản ứng trùng hợp, nghĩa là cộng liên tiếp với nhau để tạo thành những phân tử mạch rất dài, có khối lượng phân tử lớn, được gọi là polymer.

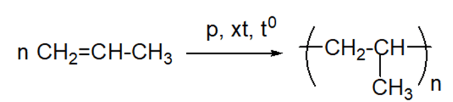
Câu hỏi trang 88 Câu hỏi 8
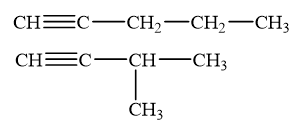
Viết công thức cấu tạo của các alkyne có công thức phân tử C5H8 và tác dụng được với dung dịch silver nitrate trong ammonia.

Advertisements (Quảng cáo)
Alk-1-yne có phản ứng với dung dịch silver nitrate trong ammonia, tạo kết tủa vàng nhạt.

Các công thức alk - 1 – yne có công thức phân tử C5H8 tác dụng được với dung dịch silver nitrate trong ammonia:
Câu hỏi trang 89 TN 1
Thí nghiệm 1. Điều chế và thử tính chất của ethylene
Chuẩn bị: Ethanol, dung dịch sulfuric acid đặc, nước bromine, dung dịch KMnO4 1%, dung dịch NaOH đặc; ống nghiệm, giá thí nghiệm, ống dẫn khí hình chữ L, ống dẫn khí hình chữ Z có một đầu được vuốt nhọn, đèn cồn, bông.
Tiến hành: Cho 2 mL ethanol vào ống nghiệm khô, thêm dần từng giọt 4 mL dung dịch sulfuric acid đặc (cho chảy dọc theo thành ống nghiệm), lắc đều. Cho vào ống nghiệm một ít cát hoặc 1 – 2 mảnh sứ xốp. Kẹp ống nghiệm lên giá và lắp với ống dẫn khí hình chữ L qua phần ống nối có mẩu bông tẩm dung dịch NaOH đặc. Đun nóng ống nghiệm và sục ống dẫn khí vào ống nghiệm có chứa khoảng 1 mL nước bromine. Khi nước bromine bị mất màu thì thay ống nghiệm bằng ống nghiệm khác có chứa 1 mL dung dịch KMnO4 1%. Khi màu tím biến mất thì thay ống dẫn khí hình chữ L bằng ống dẫn khí hình chữ Z (đầu được vuốt nhọn hướng lên phía trên) và đốt khí thoát ra ở đầu ống dẫn khí.
Yêu cầu: Quan sát, viết phương trình hoá học và giải thích hiện tượng xảy ra.

Alkene làm mất màu nước bromine, thuốc tím, khi cháy tỏa nhiều nhiệt.

- Hiện tượng: khí sinh ra làm mất màu nước bromine, thuốc tím, khi đốt cháy tỏa ra nhiều nhiệt.
- Giải thích hiện tượng: Khí ethylene sinh ra từ phản ứng tách nước ethanol (xúc tác sulfuric acid đặc), ethylene phản ứng với dung dịch bromine và dung dịch thuốc tím, làm mất màu hai dung dịch trên. Khi đốt cháy khí ethylene, phản ứng tỏa ra nhiều nhiệt.
- Phương trình hóa học:
Câu hỏi trang 89 Vận dụng 2
Hãy trình bày cách phân biệt hex-1-yne (CH3(CH2)3C≡CH) và hex-2-yne (CH3C≡C(CH2)2CH3) chứa trong hai lọ giống nhau.

Alk-1-yne có phản ứng với dung dịch silver nitrate trong ammonia, tạo kết tủa vàng nhạt.

Đánh số cho từng lọ bị mất nhãn, trích dung dịch trong mỗi lọ vào mẫu thử, đánh số cho mẫu thử tương ứng với các lọ bị mất nhãn. Nhỏ vài giọt dung dịch silver nitrate trong ammonia vào hai mẫu thử.
Mẫu thử xuất hiện kết tủa màu vàng nhạt là hex-1-yne.
CH3(CH2)3C≡CH + (Ag(NH3)2)OH → CH3(CH2)3C≡CAg ↓ + 2NH3 + H2O
Mẫu thử không có hiện tượng là hex-2-yne.
Câu hỏi trang 89 Câu hỏi 9
Viết phương trình hoá học của phản ứng cháy hoàn toàn của alkane, alkene, alkyne ở dạng công thức tổng quát. So sánh tỉ lệ số mol carbon dioxide và nước tạo ra trong các trường hợp trên.CH

Công thức tổng quát của alkane: CnH2n+2 (n ≥ 1)
Công thức tổng quát của alkene: CnH2n (n ≥ 2)
Công thức tổng quát của alkyne: CnH2n-2 (n ≥ 2)

Alkane:
\( \Rightarrow \frac{{{{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}}}{{{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}{\rm{ = }}\frac{{\rm{n}}}{{{\rm{2n + 1}}}}{\rm{ < 1 hay }}{{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}{\rm{ < }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}\)
Alkene:
\( \Rightarrow \frac{{{{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}}}{{{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}{\rm{ = }}\frac{{\rm{n}}}{{\rm{n}}}{\rm{ = 1 hay }}{{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}\)
Alkyne:
\( \Rightarrow \frac{{{{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}}}{{{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}{\rm{ = }}\frac{{\rm{n}}}{{{\rm{n - 1}}}}{\rm{ > 1 hay }}{{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}{\rm{ > }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}\)
(Coi số mol của alkane, alkene và alkyne là 1 mol)
Câu hỏi trang 89 TN 2
Thí nghiệm 2. Điều chế và thử tính chất của acetylene
Chuẩn bị: Đất đèn (thành phần chính là calcium carbide), nước bromine, dung dịch KMnO4 1%; ống nghiệm, giá thí nghiệm, ống dẫn khí hình chữ L, ống dẫn khí hình chữ Z có một đầu được vuốt nhọn.
Tiến hành: Cho 2 mL nước vào ống nghiệm, thêm vào đó vài viên đất đèn bằng hạt ngô, rồi đậy nhanh ống nghiệm bằng nút có gắn ống dẫn khí hình chữ L. Sục ống dẫn khí vào ống nghiệm có chứa khoảng 1 mL nước bromine, khi nước bromine bị mất màu thì thay ống nghiệm bằng ống nghiệm khác có chứa 1 mL dung dịch KMnO4 1%. Khi màu tím biến mất thì thay ống dẫn khí hình chữ L bằng ống dẫn khí hình chữ Z (đầu được vuốt nhọn hướng lên phía trên) và đốt khí thoát ra ở đầu ống dẫn khí.
Yêu cầu: Quan sát, viết phương trình hoá học và giải thích hiện tượng xảy ra.

Alkyne làm mất màu nước bromine, thuốc tím, khi cháy tỏa nhiều nhiệt.

- Hiện tượng: khí sinh ra làm mất màu nước bromine, thuốc tím, khi đốt cháy tỏa ra nhiều nhiệt.
- Giải thích hiện tượng: Khí acetylene sinh ra từ phản ứng đốt cháy đất đèn, acetylene phản ứng với dung dịch bromine và dung dịch thuốc tím, làm mất màu hai dung dịch trên. Khi đốt cháy khí ethylene, phản ứng tỏa ra nhiều nhiệt.
- Phương trình hóa học:
Câu hỏi trang 89 Luyện tập 5
Ở nhiệt độ cao và có mặt của dung dịch sulfuric acid đặc, ethanol (CH3CH2OH) bị chuyển hoá thành ethylene và nước.
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Vì sao cần dẫn khí từ ống nghiệm điều chế ethylene qua ống có chứa mẫu bông tẩm dung dịch NaOH đặc?

a) Tách nước từ ethanol (xúc tác dung dịch sulfuric acid đặc) thu được ethylene.
b) Dung dịch NaOH phản ứng với CO2, SO2,…nhưng không phản ứng với ethylene.

a) 
b) Quá trình điều chế khí ethylene sinh ra các khí khác (tạp chất) như CO2, SO2,… Để thu được ethylene tinh khiết, người ta dẫn khí từ ống nghiệm điều chế ethylene qua ống có chứa mẫu bông tẩm dung dịch NaOH đặc để:
+ Các tạp chất phản ứng với dung dịch NaOH đặc.
+ Khí ethylene không phản ứng với dung dịch NaOH đặc.
Do đó ta thu được ethylene tinh khiết.
Câu hỏi trang 90 Vận dụng 3
Thực vật có xu hướng sinh ra nhiều ethylene hơn khi bị thương tổn hay gặp điều kiện bất lợi (hạn hán, ngập úng,...). Vì sao khi bày bán trong siêu thị, rau thường được chứa trong các túi nylon có lỗ?

Ethylene là hormon sinh trưởng của thực vật, có tác dụng làm cây mau già và quả mau chín. Ethylene được dùng để làm chín trái cây, điều khiển quá trình sinh mủ của cây cao su,...

Khi bày bán trong siêu thị, rau thường được chứa trong các túi nylon có lỗ để tránh tích tụ khí ethylene do rau sinh ra, giúp rau tươi lâu hơn, không bị úa, hư hỏng.
Bài tập Bài 1
Viết công thức cấu tạo của các chất có tên dưới đây:
a) pent-2-ene
b) 2-methylbut-2-ene
c) 3-methylbut-1-yne
d) 2-methylpropene

Công thức cấu tạo biểu diễn thứ tự và cách thức liên kết (liên kết đơn, liên kết đôi, liên kết ba) giữa các nguyên tử trong phân tử.

Bài tập Bài 2
Viết công thức cấu tạo của sản phẩm chính tạo thành trong các phản ứng dưới đây:

- Alkene cộng hydrogen tạo thành alkane. Phản ứng cộng hydrogen vào alkyne với những xúc tác như platinum, palladium hay nickel chủ yếu tạo thành alkane mà không dừng lại ở giai đoạn tạo alkene.
- Quy tắc Markovnikov: Trong phản ứng cộng HX vào hydrocarbon không no, nguyên tử H ưu tiên cộng vào nguyên tử carbon mang liên kết đôi có nhiều hydrogen hơn (bậc thấp hơn) còn nguyên tử X cộng vào nguyên tử carbon mang liên kết đôi chứa it hydrogen hơn (bậc cao hơn).

Bài tập Bài 3
Trình bày phương pháp hoá học để phân biệt các khí: ethane, ethylene và acetylene.

Alkene, alkyne làm mất màu nước bromine.
Alk-1-yne có phản ứng với dung dịch silver nitrate trong ammonia, tạo kết tủa vàng nhạt.

- Dẫn lần lượt từng khí qua dung dịch silver nitrate trong ammonia, khí làm dung dịch silver nitrate trong ammonia xuất hiện kết tủa vàng là acetylene. Hai khí không có hiện tượng là ethane và ethylene.
- Dẫn hai khí trên vào dung dịch bromine. Khí làm mất màu dung dịch bromine là ethylene, khí không làm mất màu dung dịch bromine là ethane.
- Phương trình hóa học:
HC≡CH + 2(Ag(NH3)2)OH → AgC≡CAg ↓ + 4NH3 + 2H2O
CH2=CH2 + Br2 → CH2Br-CH2Br
Bài tập Bài 4
Cho các đoạn mạch polymer như ở dưới đây:
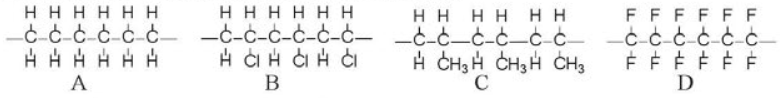
Viết phương trình hoá học tổng hợp các polymer đó từ các alkene tương ứng.

Ở điều kiện nhiệt độ, xúc tác và áp suất thích hợp, các phân tử alkene có thể tham gia phản ứng trùng hợp, nghĩa là cộng liên tiếp với nhau để tạo thành những phân tử mạch rất dài, có khối lượng phân tử lớn, được gọi là polymer.

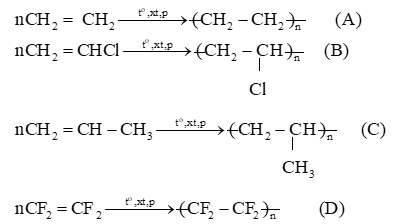
Bài tập Bài 5
Trong một phương pháp tổng hợp polyethylene (PE), các phân tử ethylene đã được hoà tan trong dung môi phản ứng với nhau để tạo thành polymer. Có thể sử dụng methyl alcohol, nước, cyclohexane hay hex-1-ene làm dung môi cho phản ứng trùng hợp PE được không? Giải thích.

Alkene là các chất kém phân cực, vì thế chúng hầu như không tan trong nước, nhưng tan tốt trong các dung môi hữu cơ như methanol, acetone, diethyl ether, chloroform,...
Ở điều kiện nhiệt độ, xúc tác và áp suất thích hợp, các phân tử alkene có thể tham gia phản ứng trùng hợp, nghĩa là cộng liên tiếp với nhau để tạo thành những phân tử mạch rất dài, có khối lượng phân tử lớn, được gọi là polymer.

- Có thể sử dụng methyl alcohol, cyclohexane làm dung môi cho phản ứng trùng hợp PE vì ethylene hòa tan trong các dung môi trên.
- Không thể dùng nước để làm dung môi cho phản ứng trùng hợp PE vì ethylene không tan trong nước.
- Không thể dùng hex – 1 – ene làm dung môi cho phản ứng trùng hợp PE, tuy hex – 1 – ene hòa tan được ethylene nhưng hex – 1 – ene có thể tham gia phản ứng trùng hợp.
Do đó nếu dùng hex – 1 – ene làm dung môi cho phản ứng trùng hợp PE, ta sẽ thu thêm polymer khác ngoài PE.
