|
Câu hỏi: 2. Phản ứng xảy ra khi cho khí Cl2 tác dụng với nước là một phản ứng thuận nghịch. Viết phương trình hóa học của phản ứng, xác định phản ứng thuận, phản ứng nghịch. 3. Nhận xét nào sau đây không đúng? A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu. B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu. C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn. D. Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện. |

2. Phản ứng xảy ra khi cho khí Cl2 tác dụng với nước là:
Cl2 + H2O ⇌ HClO + HCl
3. Đáp án C: Phản ứng một chiều có thể xảy ra hoàn toàn hoặc không hoàn toàn, phụ thuộc vào điều kiện phản ứng.

2. Phương trình hoá học của phản ứng xảy ra khi cho khí Cl2 tác dụng với nước:
Cl2(aq) + H2O(l) ⇌ HCl(aq) + HClO(aq)
Phản ứng thuận: Cl2 + H2O → HCl + HClO
Phản ứng nghịch: HCl + HClO → Cl2 + H2O
3. Đáp án C. vì phản ứng một chiều là phản ứng chỉ xảy ra một chiều, không có sự tạo lại chất ban đầu, nên phản ứng một chiều có thể xảy ra hoàn toàn hoặc không hoàn toàn. Ví dụ như phản ứng cháy là một phản ứng một chiều, có thể xảy ra hoàn toàn hoặc không hoàn toàn, tùy thuộc vào điều kiện phản ứng.
|
Câu hỏi: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g). Số liệu về sự thay đổi số mol các chất trong bình phản ứng ở thí nghiệm 1 được trình bày trong Bảng 1.1 dưới đây: a) Vẽ đồ thị biểu diễn sự thay đổi số mol các chất theo thời gian. b) Từ đồ thị, nhận xét về sự thay đổi số mol của các chất theo thời gian. c) Viết biểu thức định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó dự đoán sự thay đổi tốc độ của mỗi phản ứng theo thời gian (biết các phản ứng này đều là phản ứng đơn giản). Advertisements (Quảng cáo) d) Bắt đầu từ thời điểm nào thì số mol các chất trong hệ phản ứng không thay đổi nữa? |

a) Vẽ biểu đồ đường biểu diễn, trục tung là số mol, trục hoành là thời gian.
b) Nhận xét: Ban đầu chưa có sản phẩm, sau đó số mol chất tham gia giảm dần, số mol sản phẩm tăng dần cho tới khi cân bằng, số mol các chất trong hệ không thay đổi nữa.
c) Biểu thức định luật tác dụng khối lượng:
- Đối với phản ứng thuận: vthuận = k.[A]a.[B]b
- Đối với phản ứng nghịch: vnghịch = k.[C]c
Dự đoán: dựa vào biểu thức định luật tác dụng khối lượng. Tốc độ phản ứng thuận phụ thuộc vào nồng độ chất tham gia, tốc độ phản ứng nghịch phụ thuộc vào nồng độ chất sản phẩm.
d) Thời điểm phản ứng đạt trạng thái cân bằng thì số mol các chất không thay đổi nữa.

a)
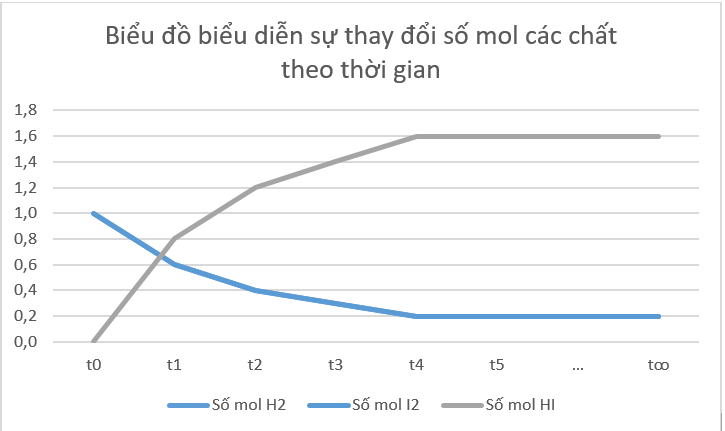
b) Từ đồ thị ta thấy: Lúc đầu số mol sản phẩm bằng 0, theo thời gian, số mol chất tham gia (hydrogen, iodine) giảm dần, số mol chất sản phẩm (hydrogen iodide) tăng dần, đến khi số mol của các chất hydrogen, iodine, hydrogen iodide không thay đổi nữa.
c) Biểu thức định luật tác dụng khối lượng:
- Đối với phản ứng thuận:
vthuận = \({\rm{k}}{\rm{.}}{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}}{\rm{.}}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}}\)
- Đối với phản ứng nghịch:
vnghịch = \({\rm{k’}}{\rm{.C}}_{{\rm{HI}}}^2\)
Dự đoán:
- Ban đầu tốc độ phản ứng thuận giảm dần, sau một thời gian tốc độ phản ứng thuận không thay đổi theo thời gian.
- Ban đầu tốc độ phản ứng nghịch tăng dần, sau một thời gian tốc độ phản ứng nghịch không thay đổi theo thời gian.
d) Tại thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì số mol các chất trong hệ phản ứng không thay đổi nữa.
