Câu hỏi trang 100
Kim loại nhóm IIA và hợp chất của chúng có nhiều ứng dụng trong đời sống, sản xuất.
Kim loại nhóm IIA và hợp chất của chúng có những tính chất gì?

Nêu tính chất của kim loại nhóm IIA và hợp chất của kim loại nhóm IIA.

- Kim loại nhóm IIA:
+ Tính chất vật lí: Nhiệt độ nóng chảy, khối lượng riêng và độ cứng của kim loại nhóm IIA cao hơn so với kim loại nhóm IA cùng chu kì. Kim loại nhóm IIA là những kim loại nhẹ (D 3).
+ Tính chất hóa học: Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dần từ Be đến Ba.
\({\rm{M}} \to {{\rm{M}}^{2 + }} + 2{\mathop{\rm e}\nolimits} \)
- Hợp chất của kim loại nhóm IIA:
+ Muối carbonate: Muối carbonate tác dụng với dung dịch acid loãng, phản ứng với H2O khi có mặt CO2. Dưới tác dụng của nhiệt, muối carbonate của kim loại nhóm IIA bị phân huỷ tạo thành oxide.
+ Muối nitrate: Khi đun nóng, muối nitrate của kim loại nhóm IIA phân huỷ thành oxide.
+ Độ bền nhiệt của muối carbonate, muối nitrate của kim loại nhóm IIA có xu hướng tăng dần từ muối của Mg2+ đến muối của Ba2+.
Câu hỏi trang 101
Dựa vào Bảng 18.2, hãy nhận xét sự thay đổi nhiệt độ nóng chảy và khối lượng riêng của kim loại nhóm IIA. Giải thích.

Dựa vào Bảng 18.2 để nhận xét.
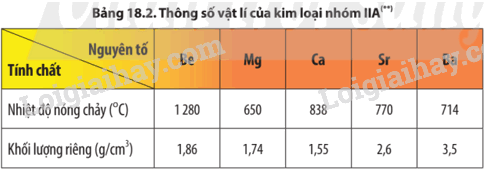

Sự biến đổi nhiệt độ nóng chảy của kim loại nhóm IIA không theo quy luật do cấu trúc mạng tinh thể của kim loại nhóm IIA khác nhau:
+ Beryllium và magnesium có cấu trúc lục phương chặt khít;
+ Calcium và strontium có cấu trúc lập phương tâm mặt;
+ Barium có cấu trúc lập phương tâm khối.
Câu hỏi trang 102 Tranh luận (TL)
Dự đoán tính chất hoá học đặc trưng của kim loại nhóm IIA và so sánh với kim loại nhóm IA.

Tính chất hóa học đặc trưng của kim loại là tính khử.
Dựa vào vị trí của nhóm IIA trong bảng tuần hoàn các nguyên tố hóa học để so sánh.

Kim loại nhóm IIA có tính khử mạnh nhưng yếu hơn kim loại nhóm IA.
Câu hỏi trang 102 Luyện tập (LT)
Hoàn thành phương trình hoá học của các phản ứng sau:
\(\begin{array}{l}{\rm{a) Be + }}{{\rm{O}}_2} \to \\{\rm{b) Ca + }}{{\rm{O}}_2} \to \\{\rm{c) Ba + }}{{\rm{O}}_2} \to \end{array}\)

Khi đốt nóng, kim loại nhóm IIA cháy trong không khí tạo oxide, phản ứng toả nhiều nhiệt: \({\rm{M}} + {{\rm{O}}_2} \to 2{\rm{MO}}\)

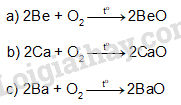
Câu hỏi trang 103 Tranh luận (TL) 1
Dựa vào Bảng 18.3, nhận xét sự biến đổi độ tan từ Be(OH)2 đến Ba(OH)2.



Độ tan của các hydroxide trong nước tăng theo thứ tự:
Be(OH)22222
Câu hỏi trang 103 Luyện tập (LT)
Hoàn thành phương trình hoá học của các phản ứng sau:
\(\begin{array}{l}{\rm{a) Ca + }}{{\rm{H}}_2}{\rm{O}} \to \\{\rm{b) Ba + }}{{\rm{H}}_2}{\rm{O}} \to \end{array}\)

Berrylium không tác dụng với nước và hơi nước do có màng oxide bền bảo vệ bề mặt. Magnesium phản ứng chậm với nước ở nhiệt độ thường và phản ứng nhanh hơn khi đun nóng. Các kim loại Ca, Sr, Ba khử H2O ở nhiệt độ thường.
\({\rm{M }} + {\rm{ }}2{{\rm{H}}_{\rm{2}}}{\rm{O }} \to {\rm{M}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ }} + {\rm{ }}{{\rm{H}}_{\rm{2}}} \uparrow \)
(với M là Ca, Sr hoặc Ba)

\({\rm{a) Ca }} + {\rm{ }}2{{\rm{H}}_{\rm{2}}}{\rm{O }} \to {\rm{Ca}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ }} + {\rm{ }}{{\rm{H}}_{\rm{2}}} \uparrow \)
\({\rm{b) Ba }} + {\rm{ }}2{{\rm{H}}_{\rm{2}}}{\rm{O }} \to {\rm{Ba}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ }} + {\rm{ }}{{\rm{H}}_{\rm{2}}} \uparrow \)
Câu hỏi trang 103 Tranh luận (TL) 2
Dự đoán khả năng phản ứng của muối carbonate kim loại nhóm IIA với dung dịch acid loãng.

Muối carbonate của kim loại nhóm IIA là muối của acid yếu, tác dụng được với nhiều acid vô cơ và hữu cơ, giải phóng khí carbon dioxide.

Muối carbonate kim loại nhóm IIA với dung dịch acid loãng giải phóng khí carbon dioxide.
Câu hỏi trang 104 Tranh luận (TL) 1
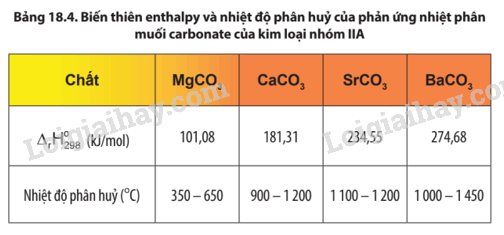
Quan sát Bảng 18.4, nhận xét về xu hướng biến đổi độ bền nhiệt của muối carbonate từ MgCO3 đến BaCO3.

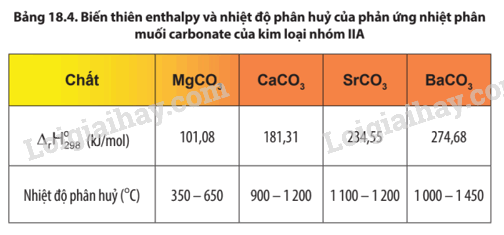

Độ bền nhiệt của muối carbonate của kim loại nhóm IIA có xu hướng tăng dần từ muối của MgCO3 đến muối của BaCO3.
Câu hỏi trang 104 Tranh luận (TL) 2
Quan sát Bảng 18.5, nhận xét xu hướng biến đổi độ bền nhiệt của muối nitrate. Từ đó rút ra mối quan hệ giữa độ bền nhiệt và giá trị biến thiên enthalpy của phản ứng nhiệt phân muối nitrate kim loại nhóm IIA.


- Độ bền nhiệt của muối nitrate của kim loại nhóm IIA có xu hướng tăng dần từ muối của Mg(NO3)2 đến muối của Ba(NO3)2.
- Độ bền nhiệt của muối nitrate càng lớn, biến thiên enthalpy của phản ứng nhiệt phân muối nitrate càng lớn.
Câu hỏi trang 104 Luyện tập (LT)
Hoàn thành phương trình hoá học của các phản ứng sau:
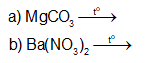

+ Muối carbonate: Dưới tác dụng của nhiệt, muối carbonate của kim loại nhóm IIA bị phân huỷ tạo thành oxide.
+ Muối nitrate: Khi đun nóng, muối nitrate của kim loại nhóm IIA phân huỷ thành oxide.

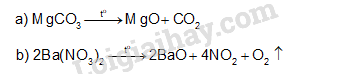
Câu hỏi trang 105 Vận dụng (VD)
Giải thích và viết phương trình hoá học của các phản ứng xảy ra trong quá trình sau:
a) Vôi sống tiếp xúc lâu ngày trong không khí sẽ bị giảm chất lượng.
b) Trên bể mặt các hố vôi tôi lâu ngày thường có màng chất rắn.

Vôi sống và vôi tôi phản ứng với hơi nước và carbondioxide trong không khí tạo thành các hợp chất khác.

a) Vôi sống (CaO) để lâu ngoài không khí sẽ có phản ứng với hơi nước và carbondioxide trong không khí nên chất lượng bị giảm.
\({\rm{CaO}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Ca(OH}}{{\rm{)}}_{\rm{2}}}\)
\({\rm{CaO}} + {\rm{C}}{{\rm{O}}_2} \to {\rm{CaC}}{{\rm{O}}_3}\)
b) Các hố vôi tôi (Ca(OH)2) khi để lâu ngày sẽ có phản ứng với CO2 trong không khí tạo một lớp màng rắn CaCO3.
\({\rm{Ca(OH}}{{\rm{)}}_2} + {\rm{C}}{{\rm{O}}_2} \to {\rm{CaC}}{{\rm{O}}_3} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Câu hỏi trang 105 Tranh luận (TL)
Thực hiện Thí nghiệm 1 theo hướng dẫn, nêu hiện tượng xảy ra. Rút ra kết luận về độ tan của các muối sulfate. Giải thích.

CaSO4 ít tan; BaSO4 không tan.

- Hiện tượng: Ống nghiệm (1) chứa kết tủa CaSO4 xuất hiện kết tủa chậm hơn so với ống nghiệm (2) chứa kết tủa BaSO4.
- Kết luận: CaSO4 có độ tan lớn hơn BaSO4.
- Giải thích: Vì CaSO4 ít tan, BaSO4 không tan nên kết tủa CaSO4 xuất hiện kết tủa chậm hơn so với kết tủa BaSO4.
Advertisements (Quảng cáo)
Câu hỏi trang 106 Tranh luận (TL)
Thực hiện Thí nghiệm 2 theo hướng dẫn, nêu hiện tượng xảy ra. Viết phương trình hoá học của các phản ứng xảy ra và giải thích.

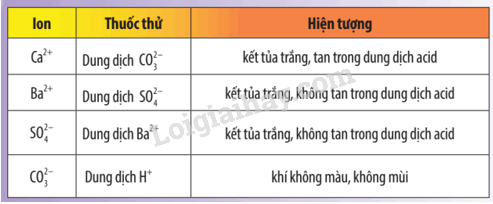

- Ống nghiệm (1): xuất hiện kết tủa trắng BaSO4.
\({\rm{BaC}}{{\rm{l}}_{\rm{2}}} + {{\mathop{\rm Na}\nolimits} _2}S{O_4} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow + 2{\rm{NaCl}}\)
- Ống nghiệm (2): xuất hiện kết tủa trắng CaCO3, sau đó kết tủa tan và xuất hiện bọt khí CO2 không màu.
\({\rm{CaC}}{{\rm{l}}_{\rm{2}}} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}} \to {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \downarrow + 2{\rm{NaCl}}\)
\({\rm{CaC}}{{\rm{O}}_{\rm{3}}} + 2{\rm{HCl}} \to {\rm{CaC}}{{\rm{l}}_{\rm{2}}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
- Ống nghiệm (3): xuất hiện kết tủa trắng BaSO4.
\({{\rm{K}}_{\rm{2}}}S{O_4} + {\rm{BaC}}{{\rm{l}}_{\rm{2}}} \to 2{\rm{KCl + BaS}}{{\rm{O}}_{\rm{4}}} \downarrow \)
- Ống nghiệm (4): xuất hiện bọt khí CO2 không màu.
\({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_{\rm{3}}} + 2{\rm{HCl}} \to 2{\rm{NaCl}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Câu hỏi trang 106 Luyện tập (LT)
Trình bày cách phân biệt 3 dung dịch không màu Na2CO3, K2SO4, Ba(NO3)2 bằng phương pháp hóa học.



- Trích các dung dịch trên làm mẫu thử và đánh số thứ tự.
- Nhỏ dung dịch HCl vào các mẫu thử:
+ Mẫu thử xuất hiện bọt khí không màu chứa dung dịch Na2CO3.
+ Mẫu thử không xuất hiện hiện tượng chứa dung dịch K2SO4 và dung dịch Ba(NO3)2.
- Nhỏ dung dịch Ba(OH)2 vào hai mẫu thử chứa dung dịch K2SO4 và dung dịch Ba(NO3)2:
+ Mẫu thử xuất hiện kết tủa trắng chứa dung dịch K2SO4.
+ Mẫu thử không hiện tượng chứa dung dịch Ba(NO3)2.
Phương trình hóa học:
\({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_{\rm{3}}} + 2{\rm{HCl}} \to 2{\rm{NaCl}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
\({{\rm{K}}_{\rm{2}}}S{O_4} + {\rm{Ba(OH}}{{\rm{)}}_{\rm{2}}} \to 2{\rm{KOH + BaS}}{{\rm{O}}_{\rm{4}}} \downarrow \)
Câu hỏi trang 107 Tranh luận (TL) 1
Vẽ sơ đồ tư duy để nêu một số ứng dụng của đơn chất và hợp chất của kim loại nhóm IIA.

Vẽ sơ đồ tư duy để nêu một số ứng dụng của đơn chất và hợp chất của kim loại nhóm IIA.

Học sinh tự vẽ sơ đồ từ duy với các từ khóa được tìm kiếm trong mục 3 trang 107 sách giáo khoa.
Câu hỏi trang 107 Vận dụng (VD)
Hãy tìm hiểu những thực phẩm có thể giúp bổ sung calcium cho cơ thể?

Tìm hiểu thông tin trên dựa vào sách báo, internet.

Thực phẩm có thể giúp bổ sung calcium cho cơ thể:
+ Sữa và các chế phẩm từ sữa (phô mai, sữa chua).
+ Cá mòi.
+ Rau có màu xanh đậm (cải xoăn, cái búp, súp lơ xanh,...).
+ Đậu phụ.
+ Các loại đậu, hạt dầu như hướng dương, hạnh nhân, đậu đen, đậu nành,...
Câu hỏi trang 107 Tranh luận (TL) 2
Theo em, trong ba loại nước cứng, loại nào khó loại bỏ tính "cứng” nhất?

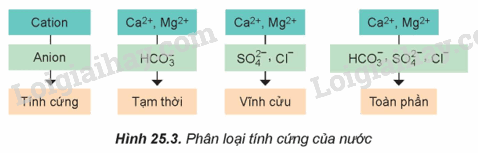

Nước cứng toàn phần chứa tính cứng của nước cứng tạm thời và nước cứng vĩnh cửu nên khó loại bỏ nhất.
Câu hỏi trang 108 Tranh luận (TL) 1
Vì sao giặt áo quần bằng nước cứng sẽ tốn xà phòng, nước xả vải hơn khi dùng nước mềm?

Nước cứng làm cho xà phòng có ít bọt, giảm khả năng tẩy rửa của nó.

Giặt áo quần bằng xà phòng (sodium stearate C17H35COONa) trong nước cứng sẽ tạo ra muối không tan là calcium stearate (C17H35COO)2Ca, chất này bám trên vải sợi, làm cho quần áo mau mục nát. Mặt khác, nước cứng làm cho xà phòng có ít bọt, giảm khả năng tẩy rửa của xà phòng nên giặt áo quần bằng nước cứng sẽ tốn xà phòng, nước xả vải hơn khi dùng nước mềm.
Câu hỏi trang 108 Tranh luận (TL) 2
Đề xuất cách làm mềm nước có tính cứng toàn phần?

Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các ion Ca2+ và Mg2+ trong nước cứng.

Để làm mềm nước cứng toàn phần, ta sử dụng Na2CO3 hoặc Na3PO4.
\({\rm{C}}{{\rm{a}}^{2 + }} + {\rm{CO}}_3^ - \to {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \downarrow \); \({\rm{3C}}{{\rm{a}}^{2 + }} + 2{\rm{PO}}_4^{3 - } \to {\rm{C}}{{\rm{a}}_3}{{\rm{(P}}{{\rm{O}}_4})_2} \downarrow \)
\({\rm{M}}{{\rm{g}}^{2 + }} + {\rm{CO}}_3^ - \to {\rm{MgC}}{{\rm{O}}_{\rm{3}}} \downarrow \); \({\rm{3M}}{{\rm{g}}^{2 + }} + 2{\rm{PO}}_4^{3 - } \to {\rm{M}}{{\rm{g}}_3}{{\rm{(P}}{{\rm{O}}_4})_2} \downarrow \)
Nước cứng tạm thời có chứa chất nào sau đây?
A. Ca(HCO3)2. B. MgSO4. C. CaCl2. D. MgCl2.

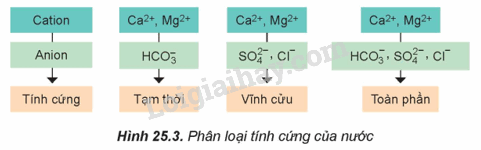

Nước cứng tạm thời có chứa Ca(HCO3)2.
→ Chọn A.
Giả sử, khi calcium tiếp xúc với không khí ẩm: đầu tiên tạo thành calcium oxide, sau đó chuyển thành calcium hydroxide, rồi thành calcium carbonate. Viết phương trình hoá học của các phản ứng trên.

Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dần từ Be đến Ba.
\({\rm{M}} \to {{\rm{M}}^{2 + }} + 2{\mathop{\rm e}\nolimits} \)

\({\rm{2Ca + }}{{\rm{O}}_2} \to 2{\rm{CaO}}\)
\({\rm{CaO}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Ca(OH}}{{\rm{)}}_{\rm{2}}}\)
\({\rm{CaO}} + {\rm{C}}{{\rm{O}}_2} \to {\rm{CaC}}{{\rm{O}}_3}\)
Viết các phương trình hoá học cho các phản ứng sau:
a) Calcium oxide tác dụng với dung dịch hydrochloric acid loãng.
b) Dung dịch sodium carbonate tác dụng với dung dịch calcium hydroxide.

Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dần từ Be đến Ba.
\({\rm{M}} \to {{\rm{M}}^{2 + }} + 2{\mathop{\rm e}\nolimits} \)

a) \({\rm{CaO}} + 2{\rm{HCl}} \to {\rm{CaC}}{{\rm{l}}_{\rm{2}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
b) \({\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}} + {\rm{Ca(OH}}{{\rm{)}}_{\rm{2}}} \to 2{\rm{NaOH}} + {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \downarrow \)
Y là hợp chất của calcium có nhiều ở dạng đá vôi, đá hoa,... Hợp chất Z có trong thành phần không khí và thường dùng để chữa cháy. Biết Z được sinh ra khi cho Y phản ứng với dung dịch acid mạnh. Xác định Y và Z, viết phương trình hoá học của phản ứng.

Y là CaCO3, Z là CO2.

- Y là hợp chất của calcium có nhiều ở dạng đá vôi, đá hoa,... nên Y là CaCO3.
Vì Z có trong thành phần không khí và thường dùng để chữa cháy và khi cho CaCO3 phản ứng với dung dịch acid mạnh thu được Z nên Z là CO2.
- Phương trình hóa học:
\(\begin{array}{l}{\rm{CaC}}{{\rm{O}}_{\rm{3}}} + 2{\rm{HCl}} \to {\rm{CaC}}{{\rm{l}}_{\rm{2}}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow + {{\rm{H}}_{\rm{2}}}{\rm{O}}\\{\rm{ Y Z}}\end{array}\)
