Câu hỏi trang 110 Mở đầu (MĐ)
Trong bảng tuần hoàn các nguyên tố hoá học, kim loại chuyển tiếp dãy thứ nhất bao gồm các nguyên tố từ Sc đến Cu. Cấu hình electron của nguyên tử các nguyên tố này có đặc điểm gì? Chúng có những tính chất vật lý và ứng dụng nào?

Nêu đặc điểm cấu hình electron, tính chất vật lý và ứng dụng của các kim loại chuyển tiếp dãy thứ nhất.

- Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng [Ar]3d1÷10 4s1÷2.
- Tính chất vật lí: Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, khối lượng riêng, độ cứng cao hơn kim loại nhóm IA và nhóm IIA trong cùng chu kì.
- Ứng dụng:
+ Đồng được dùng trong sản xuất các thiết bị như: biến thế, cầu dao điện, dây dẫn điện,...
+ Chromium được dùng mạ lên các thiết bị để chống mài mòn, chế tạo hợp kim đặc biệt.
+ Scandium, titanium được dùng để chế tạo hợp kim ứng dụng trong hàng không, vũ trụ.
+ Vanadium được dùng trong chế tạo thiết bị chịu nhiệt.
+ Sắt, manganese được dùng trong sản xuất thiết bị quốc phòng, công nghiệp, nông nghiệp, đời sống.
+ Sắt, cobalt được dùng để chế tạo nam châm điện.
+ Nickel được dùng để chế tạo các hợp kim sử dụng trong máy móc, thiết bị.
Câu hỏi trang 110 Tranh luận (TL)
Quan sát Bảng 19.1, hãy cho biết đặc điểm cấu hình electron của các nguyên tử kim loại chuyển tiếp dãy thứ nhất.

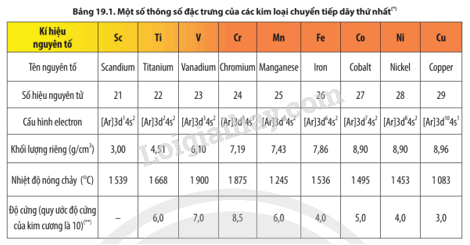

Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng [Ar]3d1÷10 4s1÷2. Nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có electron hoá trị nằm ở phân lớp 3d và 4s.
Câu hỏi trang 111
Dựa vào số liệu trong Bảng 19.1, Bảng 17.2 và Bảng 18.2, hãy nhận xét, so sánh nhiệt độ nóng chảy, khối lượng riêng, độ cứng của các kim loại chuyển tiếp dãy thứ nhất với kim loại K và Ca. Cho biết độ cứng của Ca là 1,75.

Quan sát số liệu các Bảng 19.1, Bảng 17.2 và Bảng 18.2 để nhận xét và so sánh.

- Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, khối lượng riêng, độ cứng cao hơn kim loại K và Ca.
- Thứ tự tăng dần về nhiệt độ nóng chảy, khối lượng riêng, độ cứng của các kim loại chuyển tiếp dãy thứ nhất với kim loại K và Ca là K; Ca; kim loại chuyển tiếp dãy thứ nhất.
Câu hỏi trang 112 Luyện tập (LT) 1
Lấy một số ví dụ về ứng dụng của sắt trong thực tế.

Liên hệ thực tế và tham khảo thông tin ở mục 2, trang 112, sách giáo khoa.

- Sắt được sử dụng để sản xuất gang, thép và các hợp kim khác của sắt.
- Hợp chất của sắt được sử dụng để làm chất diệt sâu bọ, pha chế sơn mực, làm chất xúc tác cho phản ứng hữu cơ, làm sơn chổng gỉ,…
- Các hợp kim của sắt có nhiều ứng dụng khác nhau như
+ Sắt, manganese được dùng trong sản xuất thiết bị quốc phòng, công nghiệp, nông nghiệp, đời sống.
+ Sắt, cobalt được dùng để chế tạo nam châm điện.
Câu hỏi trang 112 Luyện tập (LT) 2
Hãy viết cấu hình electron của các ion: Cu2+, Fe3+, Cr3+, Mn2+.

Cách viết cấu hình electron nguyên tử
+ Bước 1: Xác định số electron của nguyên tử (Z).
+ Bước 2: Điền các electron vào các phân lớp theo mức năng lượng: 1s2s2p3s3p4s3d4p5s…
+ Bước 3: (Z > 20) Viết cấu hình electron theo thứ tự lớp, phân lớp: 1s2s2p3s3p3d4s4p5s…

Cu2+: 1s22s22p63s23p63d9
Fe3+: 1s22s22p63s23p63d5
Cr3+: 1s22s22p63s23p63d3
Mn2+: 1s22s22p63s23p63d5
Câu hỏi trang 112 Tranh luận (TL) 1
Quan sát Hình 19.1, hãy nhận xét về màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất.



Trong dung dịch, ion của kim loại chuyển tiếp dãy thứ nhất thường có màu.
Câu hỏi trang 113 Tranh luận (TL) 1
Dự đoán hiện tượng xảy ra trong thí nghiệm xác định hàm lượng muối Fe(ll) bằng dung dịch thuốc tím.
Advertisements (Quảng cáo)

Dung dịch FeSO4 trong môi trường acid làm mất màu dung dịch KMnO4.
\(10{\rm{FeS}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{KMn}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} \to {\rm{ }}5{\rm{F}}{{\rm{e}}_{\rm{2}}}{\left( {{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right)_{\rm{3}}}{\rm{ }} + {\rm{ }}{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{MnS}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{O}}\)

Hiện tượng: Khi nhỏ thuốc tím vào dung dịch muối Fe(II), màu hồng của thuốc tím biến mất. Sau khi kết thúc chuẩn độ, dung dịch xuất hiện màu hồng.
Câu hỏi trang 113 Tranh luận (TL) 2
Từ kết quả chuẩn độ, xác định nồng độ Fe2+ trong dung dịch đã pha.

Học sinh dựa vào kết quả thực tế để tính nồng độ Fe2+.

Giả sử thể tích dung dịch KMnO4 trong thí nghiệm đã dùng là V (L).
Þ \({{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = 0,02{\rm{V (mol)}}\)
Theo phương trình hóa học: \({{\rm{n}}_{{\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}}}{\rm{ = 5}}{{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = 0,1{\rm{V (mol)}}\)
\( \Rightarrow {{\rm{C}}_M}{\rm{(F}}{{\rm{e}}^{2 + }}{\rm{) = }}\frac{{0,1{\rm{V}}}}{{0,01}}{\rm{ (M)}}\)
Câu hỏi trang 114 Tranh luận (TL)
Nêu hiện tượng quan sát được trong thí nghiệm nhận biết các ion Cu2+ và Fe3+, viết phương trình hoá học của phản ứng xảy ra và giải thích.

Thuốc thử để nhận biết các ion Cu2+ và Fe3+ là ion \({\rm{O}}{{\rm{H}}^ - }\).

- Khi nhỏ dung dịch NaOH vào dung dịch CuSO4, xuất hiện kết tủa màu xanh lam.
Phương trình hóa học: \(2{\rm{NaOH }} + {\rm{ CuS}}{{\rm{O}}_{\rm{4}}} \to {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} + {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \downarrow \)
Kết tủa màu xanh lam là Cu(OH)2.
- Khi nhỏ dung dịch NaOH vào dung dịch FeCl3, xuất hiện kết tủa màu nâu đỏ.
Phương trình hóa học: \(3{\rm{NaOH }} + {\rm{ FeC}}{{\rm{l}}_{\rm{3}}} \to 3{\rm{NaCl}} + {\rm{Fe(OH}}{{\rm{)}}_3} \downarrow \)
Kết tủa màu xanh lam là Fe(OH)3.
Viết cấu hình electron của các ion: Cr2+, Fe2+, Ni2+, Co2+, Co3+.

Cách viết cấu hình electron nguyên tử
+ Bước 1: Xác định số electron của nguyên tử (Z).
+ Bước 2: Điền các electron vào các phân lớp theo mức năng lượng: 1s2s2p3s3p4s3d4p5s…
+ Bước 3: (Z > 20) Viết cấu hình electron theo thứ tự lớp, phân lớp: 1s2s2p3s3p3d4s4p5s…

Cr2+: 1s22s22p63s23p63d4
Fe2+: 1s22s22p63s23p63d6
Ni2+: 1s22s22p63s23p63d8
Co2+: 1s22s22p63s23p63d7
Co3+: 1s22s22p63s23p63d6
Tìm hiểu qua sách, báo hoặc internet, hãy cho biết 5 kim loại có độ dẫn điện và dẫn nhiệt tốt nhất. Qua đó rút ra nhận xét về độ dẫn điện và dẫn nhiệt của các kim loại chuyển tiếp thuộc dãy thứ nhất.

Đa số kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, nhiệt độ sôi, độ cứng, khối lượng riêng, độ dẫn điện, độ dẫn nhiệt cao.

- Các kim loại có độ dẫn điện, dẫn nhiệt tốt nhất: Ag, Cu, Au, Al, Na.
- Nhận xét: các kim loại chuyển tiếp thuộc dãy thứ nhất có độ dẫn điện và dẫn nhiệt cao.
Để xác định hàm lượng của FeCO3 trong quặng siderite, người ta có thể làm như sau: Cân 0,300 g mẫu quặng, xử lý theo một quỵ trình thích hợp, thu được dung dịch FeSO4 trong môi trường H2SO4 loãng. Coi như dung dịch không chứa tạp chất tác dụng với KMnO4. Chuẩn độ dung dịch thu được bằng dung dịch KMnO4 0,02 M thì dùng hết 12,5 mL. Tính thành phần % theo khối lượng của FeCO3 trong quặng.

Sử dụng phương trình hóa học sau
\(10{\rm{FeS}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{KMn}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} \to {\rm{ }}5{\rm{F}}{{\rm{e}}_{\rm{2}}}{\left( {{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right)_{\rm{3}}}{\rm{ }} + {\rm{ }}{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{MnS}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{O}}\)

Ta có: \({{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = 0,02 \times {\rm{0,0125 = 0,00025 (mol)}}\)
Phương trình hóa học: \(10{\rm{FeS}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{KMn}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} \to {\rm{ }}5{\rm{F}}{{\rm{e}}_{\rm{2}}}{\left( {{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right)_{\rm{3}}}{\rm{ }} + {\rm{ }}{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{MnS}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Theo phương trình hóa học: \({{\rm{n}}_{{\rm{FeS}}{{\rm{O}}_4}}}{\rm{ = 5}}{{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = 5 \times 0,00025 = 0,00125{\rm{ (mol)}}\)
Bảo toàn nguyên tố Fe: \({{\rm{n}}_{{\rm{FeC}}{{\rm{O}}_{\rm{3}}}}}{\rm{ = }}{{\rm{n}}_{{\rm{FeS}}{{\rm{O}}_4}}} = 0,00125{\rm{ (mol)}}\)
\( \Rightarrow {{\rm{m}}_{{\rm{FeC}}{{\rm{O}}_{\rm{3}}}}}{\rm{ = }}0,00125 \times 116 = 0,145{\rm{ (g)}}\)
\( \Rightarrow \% {{\rm{m}}_{{\rm{FeC}}{{\rm{O}}_{\rm{3}}}}}{\rm{ = }}\frac{{0,145}}{{0,3}} \approx 48,3\% \)
