Câu hỏi trang 115 Mở đầu (MĐ)
Trong dung dịch, hầu hết các ion kim loại chuyển tiếp đều có màu. Các ion kim loại chuyển tiếp tồn tại trong nước dưới dạng phức chất aqua. Phức chất gồm những thành phần gì? Trong phức chất tồn tại loại liên kết nào? Phức chất có những tính chất và ứng dụng gì?

Nêu thành phần, loại liên kết, tính chất và ứng dụng của phức chất.

- Trong thành phần của phức chất có nguyên tử trung tâm và phối tử.
- Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cho – nhận.
- Tính chất của phức chất: phản ứng thế phối tử của phức chất trong dung dịch.
- Ứng dụng: Phức chất có nhiều ứng dụng trong các lĩnh vực khác nhau như y học, dược học, hoá học,...
Câu hỏi trang 116 Tranh luận (TL) 1
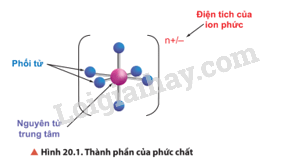
Hãy cho biết thành phần của phức chất được thể hiện trong Hình 20.1.

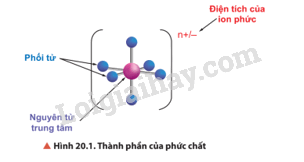

Thành phần của phức chất có nguyên tử trung tâm và phối tử.
Câu hỏi trang 116 Tranh luận (TL) 2
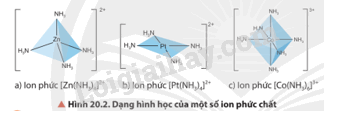
Quan sát Hình 20.2, cho biết dạng hình học của mỗi ion phức chất.

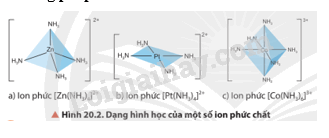

Các dạng hình học của phức chất là tứ diện, vuông phẳng và bát diện.
Câu hỏi trang 116 Luyện tập (LT)
Hãy cho biết nguyên tử trung tâm và phối tử trong các ion phức ở Hình 20.2.


|
|
Nguyên tử trung tâm |
Phối tử |
|
Hình 20.2a |
Zn2+ |
NH3 |
|
Hình 20.2b |
Pt2+ |
NH3 |
|
Hình 20.2c |
Co3+ |
NH3 |
Câu hỏi trang 117 Tranh luận (TL) 1
Quan sát Hình 20.3, hãy cho biết màu sắc của dung dịch CuSO4. Màu sắc đó là của phức chất aqua nào?

Chất điện li khi tan vào nước sẽ phân li thành các ion. Các ion không tồn tại độc lập, chúng ở dạng các tiểu phân được bao quanh bởi các phân tử nước. Trong dung dịch, cation kim loại tồn tại dưới dạng phức chất aqua, các phân tử nước là phối tử.
Hầu hết phức chất aqua của ion kim loại chuyển tiếp dãy thứ nhất đều có màu. chúng thường có dạng [M(H2O)6]n+.

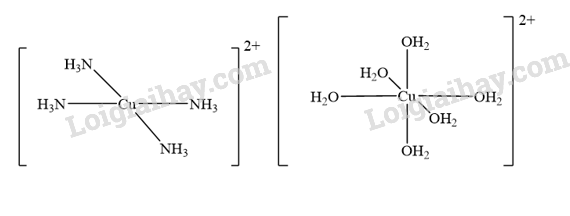
Dung dịch CuSO4 có màu xanh lam. Đây là màu sắc của [Cu(H2O)6]2+.
Câu hỏi trang 117 Tranh luận (TL) 2
Viết phương trình hoá học của phản ứng xảy ra khi hoà tan kết tủa Cu(OH)2 bằng dung dịch ammonia.

Khi cho đến dư dung dịch ammonia vào kết tủa Cu(OH)2, kết tủa tan, tạo thành dung dịch màu xanh lam chứa ion phức [Cu(NH3)4(H2O)2]2+, thường viết là [Cu(NH3)4]2+.

\({\rm{Cu}}{\left( {{\rm{OH}}} \right)_{\rm{2}}} + {\rm{ }}4{\rm{N}}{{\rm{H}}_{\rm{3}}} \to \left[ {{\rm{Cu}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{4}}}} \right]{({\rm{OH)}}_{\rm{2}}}\)
Advertisements (Quảng cáo)
Câu hỏi trang 117 Tranh luận (TL) 3
Nêu các hiện tượng quan sát được ở Thí nghiệm 1. Viết phương trình hoá học của phản ứng xảy ra trong thí nghiệm và giải thích.

Chẳng hạn khi hoà tan CuSO4 vào nước tạo thành phức chất aqua [Cu(H2O)6]2+. Có màu xanh. Khi nhỏ thêm vài giọt dung dịch kiềm sẽ tạo thành kết tủa xanh nhạt Cu(OH)2. Khi cho đến dư dung dịch ammonia vào kết tủa Cu(OH)2, kết tủa tan, tạo thành dung dịch màu xanh lam chứa ion phức [Cu(NH3)4(H2O)2]2+, thường viết là [Cu(NH3)4]2+.

- Hiện tượng: Ban đầu xuất hiện kết tủa xanh, sau đó kết tủa xanh tan thành dung dịch xanh lam.
- Giải thích:
+ Ban đầu, khi nhỏ dung dịch NH3 vào dung dịch CuSO4 thì xuất hiện kết tủa xanh Cu(OH)2.
\({{\mathop{\rm CuSO}\nolimits} _4} + 2{\rm{N}}{{\rm{H}}_{\rm{3}}} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \downarrow + {\rm{ (N}}{{\rm{H}}_{\rm{4}}}{{\rm{)}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\)
+ Tiếp tục nhỏ dung dịch NH3 đến dư, kết tủa xanh Cu(OH)2 tan trong dung dịch NH3 tạp phức chất màu xanh lam \(\left[ {{\rm{Cu}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{4}}}} \right]{({\rm{OH)}}_{\rm{2}}}\).
\({\rm{Cu}}{\left( {{\rm{OH}}} \right)_{\rm{2}}} + {\rm{ }}4{\rm{N}}{{\rm{H}}_{\rm{3}}} \to \left[ {{\rm{Cu}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{4}}}} \right]{({\rm{OH)}}_{\rm{2}}}\)
Câu hỏi trang 118 Tranh luận (TL) 1
Nêu các hiện tượng quan sát được ở Thí nghiệm 2. Viết phương trình hoá học của phản ứng xảy ra trong thí nghiệm.

Trong dung dịch CuSO4 ở dạng phức chất aqua [Cu(H2O)6]2+ màu xanh, khi nhỏ thêm dung dịch HCl thì xảy ra phản ứng thế phối tử của phức chất trong dung dịch.

- Hiện tượng: Dung dịch màu xanh đổi màu thành dung dịch màu vàng.
- Phương trình hóa học: \({\left[ {{\rm{Cu}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_{\rm{6}}}} \right]^{{\rm{2 + }}}} + {\rm{4C}}{{\rm{l}}^ - } \to {\left[ {{\rm{CuC}}{{\rm{l}}_{\rm{4}}}} \right]^{{\rm{2 - }}}} + 6{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Câu hỏi trang 118 Tranh luận (TL) 2
Em hãy vẽ sơ đó tư duy mô tả một số ứng dụng của phức chất.

Em hãy vẽ sơ đó tư duy mô tả một số ứng dụng của phức chất.

Em hãy vẽ sơ đó tư duy mô tả một số ứng dụng của phức chất.
Câu hỏi trang 119 Vận dụng (VD)
Bằng kiến thức đã học, em hãy thiết kế poster trình bày một số ứng dụng của phức chất trong y học, dược học và hoá học.

Dựa vào các thông tin được nêu trong mục 4 trang 118 sách giáo khoa.

Học sinh tự vẽ poster với các từ khóa được tìm kiếm trong mục 4 trang 118 sách giáo khoa.
Trong phức chất, giữa phối tử và nguyên tử trung tâm có loại liên kết nào sau đây?
A. Ion. B. Hydrogen. C. cho - nhận. D. Kim loại.

Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cho – nhận.

Trong phức chất, giữa phối tử và nguyên tử trung tâm có loại liên kết cho – nhận.
→ Chọn C.
Viết công thức hoá học các phức chất aqua của ion Mn2+ và ion Co3+. Biết chúng đều có dạng hình học bát diện.

Hầu hết phức chất aqua của ion kim loại chuyển tiếp dãy thứ nhất đều có màu. chúng thường có dạng [M(H2O)6]n+.

Công thức phức chất aqua của ion Mn2+ là [Mn(H2O)6]2+.
Công thức phức chất aqua của ion Co3+ là [Co(H2O)6]3+.
lon [Cu(NH3)4]2+ có dạng vuông phẳng, ion [Cu(H2O)6]2+ có dạng bát diện. Hãy vẽ dạng hình học của chúng.