Câu hỏi trang 78 Mở đầu
Trong pin điện hoá, hoá năng được chuyển thành điện năng của dòng điện một chiều thông qua phản ứng oxi hoá – khử tự xảy ra. Ngược lại, trong bình điện phân, điện năng của dòng điện một chiều được sử dụng để thực hiện phản ứng oxi hoá – khử không tự xảy ra. Vậy, quá trình điện phân tuân theo nguyên tắc nào và có ứng dụng gì trong sản xuất?

Nêu nguyên tắc và ứng dụng của điện phân.

- Nguyên tắc điện phân:
+ Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
+ Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
- Ứng dụng: điều chế, tinh chế một số kim loại, mạ điện,...
Câu hỏi trang 78 Hoạt động
Quá trình điện phân NaCl nóng chảy được tiến hành theo hai bước như sau:
Bước 1: Nung NaCl trong bình đến nóng chảy, thu được chất lỏng có khả năng dẫn điện.
Bước 2: Nhúng hai điện cực than chì vào bình đựng NaCl nóng chảy rồi nối chúng với hai cực của nguồn điện một chiều (khoảng 7 V). Các ion di chuyển về các điện cực trái dấu, ở điện cực dương có khí Cl2 thoát ra và ở điện cực âm, Na được tạo thành.
Thực hiện các yêu cầu sau:
1. Viết phương trình phân li của NaCl ở bước 1.
2. Viết quá trình xảy ra ở mỗi điện cực.
3. Viết phương trình hoá học của phản ứng xảy ra trong quá trình điện phân.

Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.

1. Phương trình phân li NaCl ở trạng thái nóng chảy: \({\rm{NaCl}} \to {\rm{N}}{{\rm{a}}^ + } + {\rm{C}}{{\rm{l}}^ - }\)
2. Các quá trình xảy ra
Tại cathode (-): \({\rm{N}}{{\rm{a}}^ + } + 1{\rm{e}} \to {\rm{Na}}\)
Tại anode (+): \(2{\rm{C}}{{\rm{l}}^ - } \to {\rm{C}}{{\rm{l}}_2} + 2{\rm{e}}\)
3. Phương trình hoá học của quá trình điện phân. 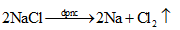
Câu hỏi trang 79
Xét thí nghiệm điện phân dung dịch (đpdd) CuCl2 với điện cực trơ (như than chì).
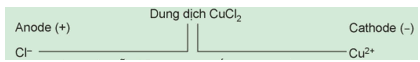
Viết quá trình xảy ra ở mỗi điện cực và viết phương trình hoá học của phản ứng điện phân.

Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.

- Quá trình xảy ra ở mỗi điện cực:
Tại cathode (-): \({\rm{C}}{{\rm{u}}^{2 + }} + 2{\rm{e}} \to {\rm{Cu}}\)
Tại anode (+): \(2{\rm{C}}{{\rm{l}}^ - } \to {\rm{C}}{{\rm{l}}_2} + 2{\rm{e}}\)
- Phương trình điện phân: 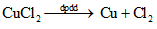
Câu hỏi trang 80 Hoạt động 1
Thí nghiệm: Điện phân dung dịch CuSO4
- Chuẩn bị:
+ Hoá chất: dung dịch CuSO4 0,5 M.
+ Dụng cụ: nguồn điện một chiều (3 – 6 vôn), ống thuỷ tinh hình chữ U, hai điện cực than chì, dây dẫn, kẹp kim loại.
- Tiến hành:
+ Lắp thiết bị thí nghiệm điện phân dung dịch CuSO4 như Hình 16.2.
+ Rót dung dịch CuSO4 0,5 M vào ống thuỷ tinh hình chữ U rồi nhúng hai điện cực than chì vào dung dịch.
+ Nối hai điện cực than chỉ với hai cực của nguồn điện và tiến hành điện phân trong khoảng 5 phút.
Quan sát hiện tượng xảy ra ở mỗi điện cực và giải thích.

Dựa vào sơ đồ điện phân để trả lời.


- Hiện tượng:
+ Ở cathode xuất hiện kết tủa đỏ bám vào điện cực.
+ Ở anode thoát ra bọt khí không màu.
- Giải thích:
Advertisements (Quảng cáo)
+ Ở cathode xảy ra quá trình khử ion kim loại tạo kim loại đồng màu đỏ: \({\rm{C}}{{\rm{u}}^{2 + }} + 2{\rm{e}} \to {\rm{Cu}}\)
→ Kim loại đồng sinh ra bám vào điện cực.
+ Ở athode xảy ra quá trình oxi hóa nước tạo khí O2 không màu: \({\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{O}}_2} + 4{{\rm{H}}^ + } + 4{\rm{e}}\)
Câu hỏi trang 80 Hoạt động 2
Điện phân dung dịch NaCl bão hoà với điện cực trơ (graphite)
a) Viết quá trình oxi hoá, quá trình khử xảy ra ở mỗi điện cực, biết sản phẩm của quá trình điện phân có khí Cl2 và H2.
b) Viết phương trình hoá học của phản ứng điện phân.
c) Trong quá trình điện phân, sản phẩm tạo thành ở hai điện cực khuếch tán vào nhau sẽ xảy ra phản ứng hoá học nào?

Thứ tự điện phân
+ Tại anode, chất khử mạnh hơn bị oxi hoá trước.
+ Tại cathode, chất oxi hoá mạnh hơn bị khử trước.

a) Tại anode (+): \(2{\rm{C}}{{\rm{l}}^ - } \to {\rm{C}}{{\rm{l}}_2} + 2{\rm{e}}\)
Tại cathode (-): \({\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} + 2{\rm{e}} \to 2{\rm{O}}{{\rm{H}}^ - } + {{\rm{H}}_2}\)
b) Phương trình hoá học của phản ứng điện phân: 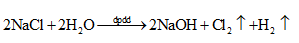
c) Phản ứng hóa học xảy ra khi sản phẩm tạo thành ở hai điện cực khuếch tán vào nhau:
\({\rm{2NaOH}} + {\rm{C}}{{\rm{l}}_{\rm{2}}} \to {\rm{NaCl}} + {\rm{NaClO}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Câu hỏi trang 84 Hoạt động
Thí nghiệm: Điện phân dung dịch NaCl (tự điều chế nước Javel để tẩy rửa)
- Chuẩn bị:
+ Hoá chất: dung dịch NaCl bão hoà, cánh hoa màu hồng.
+ Dụng cụ: nguồn điện một chiều (3 – 6 vôn), cốc thuỷ tinh 100 mL, hai điện cực than chì, dây dẫn, kẹp kim loại.
- Tiến hành:
+ Lắp thiết bị thí nghiệm điện phân dung dịch NaCl với điện cực trơ như Hình 16.3.
+ Rút khoảng 80 mL dung dịch NaCl bão hoà vào cốc rồi nhưng hai điện cực than chì vào dung dịch.
+ Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân trong khoảng 5 phút.
+ Cho một mẫu cánh hoa màu hồng vào cốc chứa khoảng 5 mL dung dịch sau điện phân.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Giải thích hiện tượng quan sát được ở mỗi điện cực.
2. Giải thích khả năng tẩy màu của dung dịch sau điện phân.
3. Tại sao nên dùng nắp đậy trong quá trình điện phân?

1. Dựa vào phương trình điện phân.
2. Khí Cl2 và dung dịch nước Javel có chứa NaClO có tính tẩy màu.
3. Khí chlorine độc.

1. Hiện tượng: ở cả hai điện cực đều thoát ra khí không màu.
→ Trong quá trình điện phân, ở cathode thu được khí H2, ở anode thu được khí Cl2.
2. Phản ứng điện phân: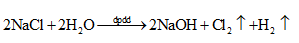
Quá trình điện phân tạo NaOH và Cl2, sau đó hai sản phẩm trên khuếch tán vào nhau và tiếp tục xảy ra phản ứng:
\({\rm{2NaOH}} + {\rm{C}}{{\rm{l}}_{\rm{2}}} \to {\rm{NaCl}} + {\rm{NaClO}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Sản phẩm của phản ứng trên là hỗn hợp nước Javel chứa NaClO, ion \({\rm{Cl}}{{\rm{O}}^ - }\)có tính oxi hóa mạnh, tẩy được màu của cánh hoa.
3. Trong quá trình điện phân sinh ra sản phẩm là khí Cl2. Khí chlorine độc nên ta cần đậy nắp bình điện phân để khí không thoát ra ngoài và để khí Cl2 tiếp tục phản ứng với dung dịch NaOH tạo nước Javel.
Câu hỏi trang 84 Câu hỏi
a) Liệt kê một số đồ vật được mạ kim loại và nêu tác dụng của việc mạ đó.
b) Kể tên một số kim loại được sản xuất bằng phương pháp điện phân.

a) Phương pháp điện phân được sử dụng trong mạ điện, trong đó ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.
Trong kỹ thuật mạ điện, các kim loại mạ thường là chromium, nickel, đồng, vàng, bạc, platinum,...
b) Sản xuất kim loại: Trong công nghiệp, các kim loại mạnh (Na, K, Ca, Mg, Al,…) được điều chế bằng phương pháp điện phân nóng chảy, các kim loại yếu và trung bình được điều chế bằng phương pháp điện phân dung dịch.

a) Các đồ vật được mạ kim loại là hộp thép mạ thiếc, nhẫn mạ vàng, huy chương mạ vàng,…
Tác dụng của việc mạ: tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.
b) Các kim loại được sản xuất bằng phương pháp điện phân:
+ Các kim loại được sản xuất bằng phương pháp điện phân nóng chảy: Na, K, Ca, Mg, Al,…
+ Các kim loại được sản xuất bằng phương pháp điện phân dung dịch: Fe, Cu, Ag, Au, Zn,…
