Câu hỏi/bài tập:
Một số đại lượng đặc trưng của các nguyên tố nhóm IIA được trình bày trong Bảng 25.1.
Thực hiện các yêu cầu sau:
1. Nhận xét xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IIA.
2. Dựa vào bán kính nguyên tử, điện tích hạt nhân, dự đoán xu hướng biến đổi tính khử từ Be đến Ba.
3. Dự đoán số oxi hoá đặc trưng của nguyên tử của nguyên tố nhóm IIA. Giải thích.

Advertisements (Quảng cáo)
Dựa vào các thông tin được đưa ra trong Bảng 25.1
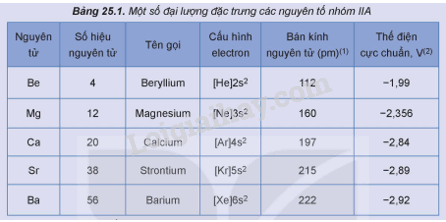

1. Bán kính nguyên tử tăng dần từ Be đến Ba.
2. Xét các nguyên tố nhóm IIA, khi đi theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần từ Be đến Ba, do đó khả năng cho các electron ở lớp ngoài cùng tăng, dẫn đến tính kim loại (tính khử) tăng từ Be đến Ba.
3. Kim loại nhóm IIA có 2 electron lớp ngoài cùng nên khi tham gia liên kết hóa học nguyên tử của các nguyên tố nhóm IIA nhường electron để có cấu hình bền của khí hiếm. Do đó điện tích duy nhất của các kim loại nhóm IIA là 2+, nên trong hợp chất số oxi hóa của chúng là +2.
