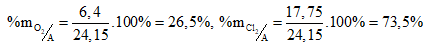Xác định thành phần phần trăm theo khối lượng và theo thể tích của hỗn hợp A.
Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,80 g magie và 8,10 g nhôm tạo ra 37,05 g hỗn hợp các muối clorua và oxit của hai kim loại.
Xác định thành phần phần trăm theo khối lượng và theo thể tích của hỗn hợp A.

\({n_{Al}} = {{8,1} \over {27}} = 0,3\,\,\left( {mol} \right),\,\,{n_{Mg}} = {{4,8} \over {24}} = 0,2\,\left( {mol} \right).\) Đặt số mol O2 và Cl2 cần dùng lần lượt là a mol và b mol.

\(\sum {{n_{e\,nhường}}} = \sum {{n_{e\,nhận}}} \Rightarrow 1,3 = 4a + 2b\,\,\,\left( * \right)\)
Áp dụng định luật bảo toàn khối lượng ta có:
\({m_{Al}} + {m_{Mg}} + {m_{{O_2}}} + {m_{C{l_2}}} = {m_Z}\)
Advertisements (Quảng cáo)
\(\Rightarrow 8,1 + 4,8 + 32a + 71b = 37,05\,\,\left( {**} \right)\)
Từ (*) và (**), ta được \(\left\{ \matrix{ a = 0,2 \hfill \cr b = 0,25 \hfill \cr} \right.\)
Thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A:
\(\% {V_{{O_2}}} = \% {n_{{O_2}}} = {{0,2.100\% } \over {\left( {0,2 + 0,25} \right)}} = 44,44\%\)
\(\% {V_{C{l_2}}} = \% {n_{C{l_2}}} = 100\% - 44,44\% = 55,56\% \)
Thành phần phần trăm về khối lượng của mỗi khí trong hỗn hợp A: