Câu hỏi/bài tập:
Tại sao trong hợp chất của halogen, nguyên tố fluorine chỉ thể hiện số oxi hoá −1, còn các nguyên tố chlorine, bromine, iodine là −1, +1, +3, +5, +7?

Dựa vào độ âm điện của fluorine để giải thích

- Nguyên tố fluorine có độ âm điện lớn nhất trong bảng tuần hoàn: 3,98 -> Trong hợp chất, fluorine sẽ chỉ hút electron về phía nguyên tử này -> Do đó fluorine chỉ có số oxi hóa -1
- Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là ns2np5
Advertisements (Quảng cáo)
- Ngoài ra (trừ F), các nguyên tố nhóm halogen còn có phân lớp d
-> Cấu hình electron lớp ngoài cùng theo ô lượng tử của các nguyên tố nhóm halogen (trừ F) là
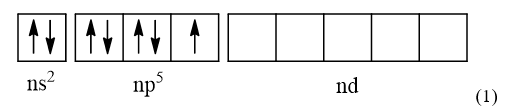
- Khi ở trạng thái kích thích, các electron ở phân lớp ns và np sẽ tách ra và chuyên sang phân lớp nd để tạo thành các cấu hình electron lớp ngoài cùng:
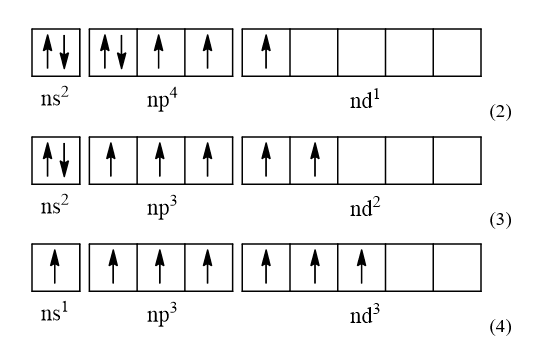
- Từ các cấu hình electron lớp ngoài cùng (1), (2), (3) và (4), nếu các nguyên tố halogen (trừ F) kết hợp với các nguyên tố có độ âm điện cao hơn như Oxygen thì các nguyên tố halogen (trừ F) sẽ có số oxi hóa dương là +1, +3, +5, +7 (tương ứng với số electron độc thân trong các cấu hình trên)
