Nồng độ mol ban đầu của các chất như sau :
[(N_2)] = 1 mol/1 ; [(H_2)] = 1,2mol/l. Bài 7.41 trang 83 Sách bài tập (SBT) Hóa học 10 - BÀI 39. LUYỆN TẬP : TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC
Thực hiện phản ứng tổng hợp amoniac : 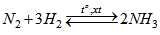
Nồng độ mol ban đầu của các chất như sau :
[\(N_2\)] = 1 mol/1 ; [\(H_2\)] = 1,2mol/l
Khi phản ứng đạt cân bằng nồng độ mol của [\(NH_3\)] = 0,2 mol/1. Tính hiệu suất của phản ứng tổng hợp amoniac.

Advertisements (Quảng cáo)
N2 + 3H2 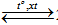 2NH3
2NH3
Ban đầu: 1mol/l 1,2mol/l
Cân bằng: — 0,3 mol/l 0,2 mol/l
Theo PTHH thì 1 mol \(N_2\) cần 3 mol \(H_2\). Ở đây chỉ có 1,2 mol \(H_2\), vì \(H_2\) thiếu nên tác dụng hết. Hiệu suất phải tính theo lượng chất tác dụng hết. Số mol \(H_2\) đã tác dụng là 0,3 mol.
Vậy h = (0,3 : 1,2). 100 = 25
Đáp số : h = 25%.
