Nhiệt phân 2,8 lít (đktc) etan ở \({1200^o}C\) rồi cho một nửa hỗn hợp khí thu được sục qua bình đựng brom (dư) thì thấy khối lượng bình này tăng thêm 1,465 g. Cho nửa hỗn hợp khí còn lại phản ứng với dung dich \(AgN{O_3}\) trong amoniac thì thu được 0,60 g kết tủa màu vàng. Biết rằng phản ứng nhiệt phân tạo ra etilen, axetilen là phản ứng không hoàn toàn, các phản ứng tiếp sau đó đều xảy ra hoàn toàn. Hãy xác định thành phần phần trăm về thể tích của hỗn hợp thu được.

Số mol \({C_2}{H_6}\) ban đầu \(\frac{{2,8}}{{22,4}} = 0,125\) mol. Đặt số mol \({C_2}{H_6}\) tham gia phản ứng (1), (2) lần lượt là 2x mol và 2y mol
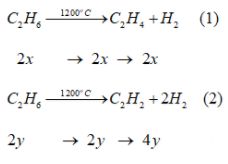
Hỗn hợp sau phản ứng: \({C_2}{H_4}\) 2x mol, \({C_2}{H_2}\) 2y mol, \({H_2} \left( {2x + 4y} \right)\) mol.
\({C_2}{H_6}\)dư [0,125 – (2x+2y)] mol.
\({C_2}{H_4} + B{r_2} \to {C_2}{H_4}B{r_2};\)
\({C_2}{H_2} + 2B{r_2} \to {C_2}{H_2}B{r_4}\)
Ta có \({m_{{C_2}{H_4}}} + {m_{{C_2}{H_2}}} = m\) bình tăng \( \Rightarrow 28x + 26y = 1,465(*)\)
Advertisements (Quảng cáo)
Từ (3) \( \Rightarrow y = \frac{{0,6}}{{240}}(**)\)
Giải hệ (*) và (**) ta được \(\left\{ \begin{array}{l}x = 0,05\\y = 0,0025\end{array} \right.\)
Hỗn hợp sau phản ứng:
\({C_2}{H_4}\) 0,1 mol, \({C_2}{H_2}\) 0,005 mol, \({H_2}\) 0,11 mol, \({C_2}{H_6}\) dư 0,02 mol.
Số mol hỗn hợp sau phản ứng: 0,1 + 0,005 + 0,11 + 0,02 = 0,235 mol
Thành phần phần trăm thể tích các khí trong hỗn hợp sau phản ứng:
\(\% {V_{{C_2}{H_4}}} = \frac{{0,1.100\% }}{{0,235}} = 42,55\% \)
\(\% {V_{{C_2}{H_2}}} = \frac{{0,005.100\% }}{{0,235}} = 2,13\% \)
\(\% {V_{{H_2}}} = \frac{{(0,1 + 0,005.2).100\% }}{{0,235}} = 46,80\% \)
\(\% {V_{{C_2}{H_6}}} = \frac{{0,02.100\% }}{{0,235}} = 8,51\% \)
