Câu hỏi/bài tập:
Để xác định hàm lượng của acetic acid trong một loại giấm ăn, một học sinh pha loãng loại giấm ăn đó mười lần rồi tiến hành chuần độ 10 mL giấm ăn sau pha loãng bằng dung dịch NaOH 0,1M, thu được kết quả như bảng sau:
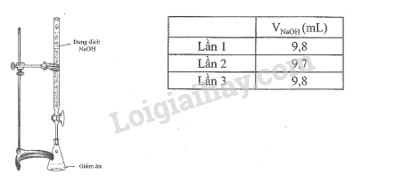
Tính hàm lượng % về thể tích acetic acid có trong loại giấm đó, biết khối lượng riêng của acetic acid là D = 1,05 g/mL, giả thiết trong thành phần giấm ăn chỉ có acetic acid phản ứng với NaOH.

Tính số mol của NaOH từ đó tính số mol của acetic acid theo phương trình hóa học và tính thể tích acetic acid.
Advertisements (Quảng cáo)

\(\begin{array}{l}{\overline {\rm{V}} _{{\rm{NaOH}}}} = \frac{{9,8 + 9,7 + 9,8}}{3} \approx 9,767{\rm{ (mL)}}\\ \Rightarrow {{\rm{n}}_{{\rm{NaOH}}}} = 9,767 \times {10^{ - 3}} \times 0,1 = 9,767 \times {10^{ - 4}}({\rm{mol}})\end{array}\)
Xét phương trình hóa học: \({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}} + {\rm{NaOH}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COONa}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
\(\begin{array}{l}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = }}{{\rm{n}}_{{\rm{NaOH}}}}{\rm{ = }}9,767 \times {10^{ - 4}}({\rm{mol}})\\ \Rightarrow {{\rm{m}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = }}9,767 \times {10^{ - 4}} \times 60 = 0,0586{\rm{ (g)}}\\ \Rightarrow {{\rm{V}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = }}\frac{{0,0586}}{{1,05}} = 0,0558{\rm{ (mL)}}\end{array}\)
Hàm lượng acetic acid trong 10 mL giấm ăn: \(\frac{{0,0558}}{{10}} \times 100\% = 0,558\% \)
Vì loại giấm ăn này đã được pha loãng 10 lần trước khi đem đi chuẩn độ, nên hàm lượng acetic acid trong giấm ăn ban đầu là 5,58%.
