Câu hỏi/bài tập:
Hỗn hợp khí X gồm N2 và H2 có tỉ khối đối với H2 bằng 3,6. Nung nóng X trong bình kín có bột Fe xúc tác, thu được hỗn hợp khí Y có số mol giảm 8% so với ban đầu. Hiệu suất của phản ứng tổng hợp NH3 là
A. 25%. B. 23%. C. 16%. D. 20%.

Tìm tỉ lệ mol của N2 và H2 thông qua tỉ khối.
Sử dụng công thức:
\({\rm{H\% }} = \frac{{{{\rm{n}}_{{\rm{sp(tt)}}}}}}{{{{\rm{n}}_{{\rm{sp(lt)}}}}}} \times 100\% \)

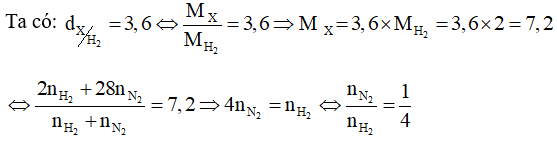
Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 4.
Chọn \({{\rm{n}}_{{{\rm{N}}_{\rm{2}}}}} = 1{\rm{ (mol)}};{\rm{ }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}}} = 4{\rm{ }}({\rm{mol}})\)
\( \Rightarrow \)Số mol khí ban đầu là: \(1 + 4 = 5{\rm{ (mol)}}\)
Advertisements (Quảng cáo)
Gọi x (mol) là số mol N2 phản ứng.
Xét cân bằng:
Ban đầu (mol): 1 4 0
Phản ứng (mol): x → 3x → 2x
Cân bằng (mol): 1 - x 4 – 3x 2x
\( \Rightarrow \)Số mol khí sau phản ứng: \({\rm{(1}} - {\rm{x}}){\rm{ + (4 — 3x) + 2x = 5}} - {\rm{2x (mol)}}\)
\( \Rightarrow \)Số mol khí giảm so với ban đầu: \(5 - (5 - 2{\rm{x}}) = 2{\rm{x (mol)}}\)
Ta có: hỗn hợp khí sau phản ứng có số mol giảm 8% so với ban đầu.
\( \Leftrightarrow 2{\rm{x}} = \frac{8}{{100}} \times 5 \Rightarrow {\rm{x}} = 0,2{\rm{ (mol)}}\)
\(\begin{array}{l} \Rightarrow {{\rm{n}}_{{{\rm{N}}_{\rm{2}}}{\rm{p/u}}}} = {\rm{x}} = 0,2{\rm{ }}({\rm{mol}})\\ \Rightarrow {\rm{H}} = \frac{{{{\rm{n}}_{{{\rm{N}}_{\rm{2}}}{\rm{p/u}}}}}}{{{{\rm{n}}_{{{\rm{N}}_{\rm{2}}}{\rm{bd}}}}}} \times 100\% = \frac{{0,2}}{1} \times 100\% = 20\% \end{array}\)
→ Chọn D.
