2.32. Đốt cháy a gam photpho đỏ trong không khí lấy dư, rồi cho sản phẩm thu được vào 500 ml dung dịch \({H_3}P{O_4}\) 85% (D = 1,7 g/ml). Sau khi phản ứng xảy ra hoàn toàn nồng độ của dung dịch \({H_3}P{O_4}\) xác định được là 92,6%. Tính giá trị của a.

Photpho cháy trong không khí lấy dư theo phản ứng :
\(4P + 5{O_2}\)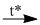 \(2{P_2}{O_5}\) (1)
\(2{P_2}{O_5}\) (1)
4 mol (4.31 g) 2 mol (2.142 g)
P2O5 tác dụng với tạo thành \({H_3}P{O_4}\) theo phản ứng :
\({P_2}{O_5} + 3{H_2}O \to 2{H_3}P{O_4}\) (2)
1 mol (142 g) 2 mol (2.98 g)
Theo phản ứng (1) : 4.31 g P tạo ra 2.142 g P2O5
a g P tạo ra \(\frac{{2.142.a}}{{4.31}} = 2,29.a\) (g) P2O5
Theo các phản ứng (1) và (2) :
Advertisements (Quảng cáo)
4.31 (g) P tạo ra 4.98 (g) \({H_3}P{O_4}\)
a (g) P tạo ra \(\frac{{4.98.a}}{{4.31}} = 3,16.a\) (g) \({H_3}P{O_4}\)
Khối lượng \({H_3}P{O_4}\) có trong 500 ml dung dịch 85% :
\(\frac{{500.1,7.85}}{{100}}\) = 722,5 (g)
Khối lượng \({H_3}P{O_4}\) sau khi đã hoà tan P2O5 : 722,5 g + 3,16.a g
Khối lượng của dung dịch \({H_3}P{O_4}\) sau khi đã hoà tan P2O5 :
500.1,7 g + 2,29.a g = 850 g + 2,29.a g
Ta có phương trình về nồng độ phần trăm của dung dịch \({H_3}P{O_4}\) :
\(\frac{{(722,5 + 3,16.a).100\% }}{{850 + 2,29.a}}\) = 92,6%
Giải phương trình được a = 62,16 g photpho.
