2.27. Nhiệt phân hoàn toàn 27,3 g một hỗn hợp rắn X gồm NaNO3 và Cu(NO3)2, thu được hỗn hợp khí có thể tích 6,72 lít (đktc).
1. Viết phương trình hoá học của các phản ứng xảy ra.
2. Tính thành phần % về khối lượng của mỗi muối trong hỗn hợp X.

1. Phương trình hoá học của các phản ứng :
2NaNO3 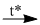 2NaNO2 + O2\( \uparrow \) (1)
2NaNO2 + O2\( \uparrow \) (1)
x mol 0,5x mol
2Cu(N03)2 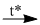 2CuO + 4NO2\( \uparrow \) + O2\( \uparrow \) (2)
2CuO + 4NO2\( \uparrow \) + O2\( \uparrow \) (2)
y mol y mol 2y mol 0,5y mol
Advertisements (Quảng cáo)
2. Đặt X và y là số mol của NaNO3 và Cu(NO3)2 trong hỗn hợp X. Theo các phản ứng (1) và (2) số mol NO2 thu được là 2y mol và tổng số mol oxi là (0,5x + 0,5y) mol.
Biết khối lượng mol của hai chất NaNO3 và Cu(NO3)2 tương ứng là 85 và 188 (g/mol), ta có hệ phương trình :
85x + 188y = 27,3 (a)
0,5x + 2y + 0,5y = \(\frac{{6,72}}{{22,4}}\) = 0,3 (b)
Giải hệ phương trình (a), (b) được : x = y = 0,1.
Phần trăm khối lượng của mỗi muối trong hỗn hợp X :
\(\% {m_{NaN{O_3}}} = \frac{{85.0,1.100\% }}{{27,3}} = 31,1\% \)
\(\% {m_{Cu{{(N{O_3})}_2}}}\) = 100% - 31,1% = 68,9%
