3.5. Đốt một mẫu than chì chứa tạp chất lưu huỳnh trong oxi. Cho hỗn hợp khí thoát ra tác dụng với lượng dư dung dịch brom, thấy có 0,32 g brom đã phản ứng. Cho khí thoát ra khỏi dung dịch brom tác dụng với lượng dư nước vôi trong, thu được 10 g kết tủa.
1. Viết phương trình hoá học của các phản ứng xảy ra.
2. Xác định phần trăm khối lượng của cacbon trong mẫu than chì.

1. Các phương trình hóa học :
\(C + {O_2}\)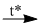 \(C{O_2}\) (1)
\(C{O_2}\) (1)
\(S + {O_2}\)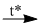 \(S{O_2}\) (2)
\(S{O_2}\) (2)
Khi đi vào dung dịch brom chỉ có \(S{O_2}\) phản ứng :
\(S{O_2} + B{{\rm{r}}_2} + 2{H_2}O \to {H_2}S{O_4} + 2HB{\rm{r}}\) (3)
Khí \(C{O_2}\) thoát ra khỏi dung dịch brom tác dụng với nước vôi trong :
Advertisements (Quảng cáo)
\(C{O_2} + Ca{(OH)_2} \to CaC{O_{3 \downarrow }} + {H_2}O\) (4)
2. Theo các phản ứng (2) và (3):
\({n_S} = {n_{S{O_2}}} = {n_{B{{\rm{r}}_2}}} = \frac{{0,32}}{{160}}\) = 2.10-3 (mol).
Khối lượng lưu huỳnh trong mẫu than chì: mS = 200.10-3.32 = 6,4.10-2 (g).
Theo các phản ứng (1) và (4) :
\({n_C} = {n_{C{O_2}}} = {n_{CaC{O_3}}} = \frac{{10}}{{100}}\) = 0,1 (mol).
Khối lượng cacbon trong mẫu than chì :
mC = 0,1.12 = 1,20 (g).
Phần trăm khối lượng cacbon trong mẫu than chì :
\(\% {m_C} = \frac{{1,2.100\% }}{{1,2 + {{6,4.10}^{ - 2}}}} = 94,94\% \)
