|
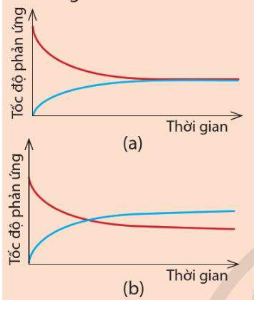
Câu hỏi 1: Cho hai đồ thị (a) và (b) dưới đây. Mỗi đồ thị biểu diễn sự thay đổi tốc độ phản ứng thuận và tốc độ phản ứng nghịch theo thời gian.
Hãy cho biết đồ thị nào thể hiện đúng Ví dụ 2. Đường màu xanh trong đồ thị đó biểu diễn tốc độ phản ứng thuận hay tốc độ phản ứng nghịch? |

Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng.
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Tuy nhiên, ở trạng thái cân bằng, phản ứng thuận và phản ứng nghịch vẫn tiếp diễn với tốc độ bằng nhau nhưng nồng độ của một chất bất kì trong phản ứng không đổi là do lượng mất đi và lượng sinh ra chất đó là bằng nhau. Như vậy, cân bằng hoá học là cân bằng động.

Sau một khoảng thời gian, màu tím của hỗn hợp khí không thay đổi, chứng tỏ nồng độ I2 không thay đổi. Nghĩa là sau một thời gian, lượng I2 sinh ra từ phản ứng nghịch và lượng I2 mất đi từ phản ứng thuận bằng nhau. Hay tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Do đó đồ thị (a) thể hiện đúng Ví dụ 2.
Advertisements (Quảng cáo)
Đường màu xanh biểu diễn tốc độ phản ứng nghịch. Ban đầu phản ứng, chưa sinh ra HI nên tốc độ phản ứng nghịch bằng 0. Sau một thời gian, lượng HI sinh ra càng nhiều, tốc độ phản ứng nghịch tăng. Sau đó, lượng HI sinh ra từ phản ứng thuận bằng lượng HI mất đi từ phản ứng nghịch, tức tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch nên đường đồ thị màu xanh trùng với đường đồ thị màu đỏ.
| Câu hỏi 2: Vì sao giá trị \[\frac{{{{\rm{k}}_{\rm{t}}}}}{{{{\rm{k}}_{\rm{n}}}}}\] là một hằng số ở nhiệt độ xác định? |

- Công thức tính tốc độ phản ứng aA+bB → cC + dD dựa vào định luật tác dụng khối lượng: \[{\rm{v = kC}}_{\rm{A}}^{\rm{a}}{\rm{C}}_{\rm{B}}^{\rm{b}}\]

H2(g) + I2(g) ⇌ 2HI
\[\begin{array}{l}{{\rm{v}}_{\rm{t}}}{\rm{ = }}{{\rm{k}}_{\rm{t}}}{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}}\\{{\rm{v}}_{\rm{n}}}{\rm{ = }}{{\rm{k}}_{\rm{n}}}{\rm{C}}_{{\rm{HI}}}^{\rm{2}}\end{array}\]
Với kt và kn lần lượt là hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch.
kt và kn chỉ phụ thuộc vào nhiệt độ nên giá trị \[\frac{{{{\rm{k}}_{\rm{t}}}}}{{{{\rm{k}}_{\rm{n}}}}}\] là một hằng số ở nhiệt độ xác định.