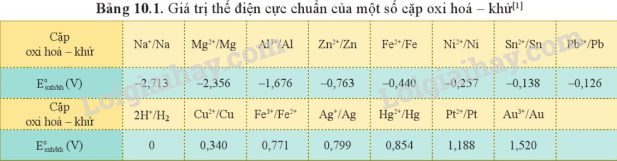
Từ giá trị thế điện cực chuẩn của các cặp oxi hóa – khử ở Bảng 10.1 và giá trị\({E_{2{H_2}{\rm{O}}/2{\rm{O}}{H^ - } + {H_2}}} = - 0,413V\)ở môi trường trung tính, cho biết phản ứng nào sau đây có thể xảy ra. Viết phương trình hóa học của phản ứng (nếu có).
a) Ag(s) + Cu2+(aq) \( \to \) b) Sn(s) + Cu2+(aq) \( \to \) c) Ni(s) + H2O(l) \( \to \)

Dựa vào thế điện cực chuẩn của các cặp oxi hóa – khử của các chất, khi thế điện cực chuẩn nhỏ hơn thì có phản ứng xảy ra.
Advertisements (Quảng cáo)

\(E_{A{g^ + }/Ag}^o > E_{C{u^{2 + }}/Cu}^o\)=> tính khử của Ag yếu hơn Cu và tính oxi hóa của Ag+ mạnh hơn Cu2+ => phản ứng (a) không xảy ra.
\(E_{S{n^{2 + }}/Sn}^o < E_{C{u^{2 + }}/Cu}^o\)=> tính khử của Sn mạnh hơn Cu và tính oxi hóa của Sn2+ mạnh hơn Cu2+ => phản ứng (b) xảy ra.
PTHH: Sn + Cu2+ \( \to \) Sn2+ + Cu
\(E_{N{i^{2 + }}/Ni}^o\)> \({E_{2{H_2}{\rm{O}}/2{\rm{O}}{H^ - } + {H_2}}}\)=> tính khử Ni yếu hơn H2O/OH- và tính oxi hóa Ni2+ mạnh hơn 2H2O/OH- => phản ứng (c) không xảy ra.
