Thí nghiệm: Điện phân dung dịch NaCl (tự điều chế nước Javel để tẩy rửa)
- Chuẩn bị:
+ Hoá chất: dung dịch NaCl bão hoà, cánh hoa màu hồng.
+ Dụng cụ: nguồn điện một chiều (3 – 6 vôn), cốc thuỷ tinh 100 mL, hai điện cực than chì, dây dẫn, kẹp kim loại.
- Tiến hành:
+ Lắp thiết bị thí nghiệm điện phân dung dịch NaCl với điện cực trơ như Hình 16.3.
+ Rút khoảng 80 mL dung dịch NaCl bão hoà vào cốc rồi nhưng hai điện cực than chì vào dung dịch.
+ Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân trong khoảng 5 phút.
+ Cho một mẫu cánh hoa màu hồng vào cốc chứa khoảng 5 mL dung dịch sau điện phân.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Giải thích hiện tượng quan sát được ở mỗi điện cực.
2. Giải thích khả năng tẩy màu của dung dịch sau điện phân.
3. Tại sao nên dùng nắp đậy trong quá trình điện phân?
Advertisements (Quảng cáo)

1. Dựa vào phương trình điện phân.
2. Khí Cl2 và dung dịch nước Javel có chứa NaClO có tính tẩy màu.
3. Khí chlorine độc.

1. Hiện tượng: ở cả hai điện cực đều thoát ra khí không màu.
→ Trong quá trình điện phân, ở cathode thu được khí H2, ở anode thu được khí Cl2.
2. Phản ứng điện phân: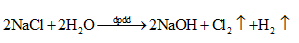
Quá trình điện phân tạo NaOH và Cl2, sau đó hai sản phẩm trên khuếch tán vào nhau và tiếp tục xảy ra phản ứng:
\({\rm{2NaOH}} + {\rm{C}}{{\rm{l}}_{\rm{2}}} \to {\rm{NaCl}} + {\rm{NaClO}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Sản phẩm của phản ứng trên là hỗn hợp nước Javel chứa NaClO, ion \({\rm{Cl}}{{\rm{O}}^ - }\)có tính oxi hóa mạnh, tẩy được màu của cánh hoa.
3. Trong quá trình điện phân sinh ra sản phẩm là khí Cl2. Khí chlorine độc nên ta cần đậy nắp bình điện phân để khí không thoát ra ngoài và để khí Cl2 tiếp tục phản ứng với dung dịch NaOH tạo nước Javel.
