
Trộn 30 ml dung dịch có chứa 2,22 g CaCl2 với 70 ml dung dịch có chứa AgNO3.
a) Hãy cho biết hiện tượng quan sát được và viết phương trình hóa học.
b) Tính khối lượng chất rắn sinh ra.
c) Tính nồng độ mol của chất còn lại trong dung dịch sau phản ứng. Cho rằng thể tích của dung dịch thay đổi không đáng kể.
a) Dựa vào chất sau phản ứng có kết tủa hay không kết tủa, màu sắc như thế nào => nêu được hiện tượng.
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl↓
b) Tính số mol CaCl2 =? ; nAgNO3 = ?
Dựa vào phương trình hóa học xem chất nào phản ứng hết, chất nào còn dư. Mọi tính toán theo chất phản ứng hết.
c) Công thức CM = n: V

a) Hiện tượng : Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là \(AgCl\)
Phương trình hóa học:
Advertisements (Quảng cáo)
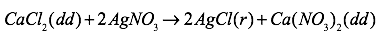
b) Khối lượng chất rắn:
\({n_{CaC{l_2}}} = {{2,22} \over {111}} = 0,02(mol)\)
\({n_{AgN{O_3}}} = {{1,7} \over {170}} = 0,01(mol)\)
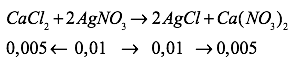
\({m_{AgCl}} = 0,01.143,5 = 1,435(g)\)
c) Nồng độ mol của các chất còn lại trong dung dịch:
\(V=30 + 70 = 100 (ml)=0,1(l)\)
Dung dịch sau phản ứng thay đổi không đáng kể nên thể tích dung dịch sau phản ứng coi như bằng thể tích dung dich trước phản ứng.
Dung dịch sau phản ứng có chứa \(0,02 – 0,005 =0,015 (mol)\) \(CaCl_2\) dư và \(0,005 mol\) \(Ca(NO_3)_2\)
Do vậy ta có
\(\eqalign{
& C{M_{CaC{l_2}}} = {{0,015} \over {0,1}} = 0,15M \cr
& C{M_{Ca{{(N{O_3})}_2}}} = {{0,005} \over {0,1}} = 0,05M \cr} \)
