I. TÍNH CHẤT VẬT LÍ
Benzen C6H6 là chất lỏng, không màu, nhẹ hơn nước, không tan trong nước, hòa tan nhiều chất như: dầu ăn, cao su, nến, iot.. có tính độc.
II. CẤU TẠO PHÂN TỬ
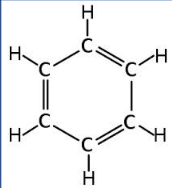
Sáu nguyên tử C trong phân tử benzen liên kết với nhau tạo thành mạch vòng sáu cạnh đều, có ba liên kết đôi xen kẽ ba liên kết đơn.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi:
Benzen cháy trong không khí tạo ra CO2 và H2O, ngọn lửa có nhiều khói đen (muội than)
C6H6 + \(\dfrac{{15}}{2}\)O2 \(\xrightarrow{{{t^o}}}\) 6CO2 + 3H2O
2. Phản ứng thế với với brom: Đun nóng hỗn hợp benzen và brom có mặt bột sắt, benzen phản ứng thế với brom
Advertisements (Quảng cáo)
PTHH: C6H6 + Br2 \(\xrightarrow{{Fe,{t^o}}}\) HBr + C6H5Br (brom bezen)
Nguyên tử H được thay thế bởi nguyên tử Br
3. Phản ứng cộng:
Benzen khó tham gia phản ứng cộng (không phản ứng với dd brom)
Trong điều kiện thích hợp benzen có phản ứng cộng với một số chất như H2, Cl2..
PTHH: C6H6 + 3H2 \(\xrightarrow{{Ni,{t^o}}}\) C6H12
Kết luận: Do cấu tạo phân tử đặc biệt nên benzen vừa có phản ứng thế, vừa có phản ứng cộng. Tuy nhiên phản ứng cộng khó hơn so với etilen và axetilen.
IV. ỨNG DỤNG
Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu.. Benzen là dung môi trong công nghiệp và trong phòng thí nghiệmhữu cơ.
