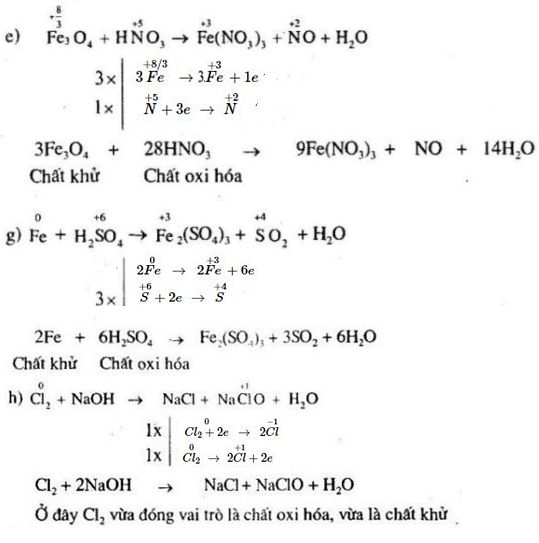Lập các phương trình hóa học của phản ứng oxi hóa – khử theo các sơ đồ dưới đây và xác định vai trò của từng chất trong phản ứng:
\(\eqalign{ & a)\,\,N{a_2}S{O_3} + KMn{O_4} + {H_2}O \to N{a_2}S{O_4}\cr& \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;+ Mn{O_2} + KOH \cr & b)\,\,FeS{O_4} + {K_2}C{r_2}{O_7} + {H_2}S{O_4} \to F{e_2}{\left( {S{O_4}} \right)_3} \cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;+ {K_2}S{O_4} + C{r_2}{\left( {S{O_4}} \right)_3} + {H_2}O \cr & c)\,\,Cu + HN{O_3} \to Cu{\left( {N{O_3}} \right)_2} + N{O_2} + {H_2}O \cr & d)\,\,Cu + HN{O_3} \to Cu{\left( {N{O_3}} \right)_2} + NO + {H_2}O \cr & e)\,\,F{e_3}{O_4} + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + NO + {H_2}O \cr & g)\,\,Fe + {H_2}S{O_4} \to F{e_2}{\left( {S{O_4}} \right)_3} + S{O_2} + {H_2}O \cr & h)\,\,C{l_2} + NaOH \to NaCl + NaClO + {H_2}O \cr} \)

Advertisements (Quảng cáo)